東京大学(東大)は10月15日、インフルエンザウイルスが感染した際に炎症反応が起こる分子メカニズムを明らかにしたと発表した。
同成果は、同大医科学研究所附属感染症国際研究センター 感染制御系 ウイルス学分野の一戸猛志 准教授らによるもの。九州大学との共同研究によるもので、詳細は2013年10月14日付(米国時間)で「米国科学アカデミー紀要(Proceedings of the National Academy of Science of the United States of America:PNAS)」に掲載された。
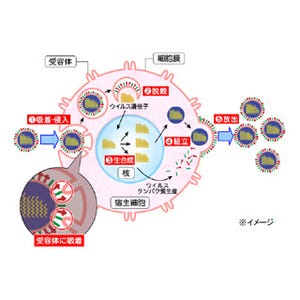
生体には、細胞内や細胞膜、エンドゾーム膜に病原体特有の分子パターンを認識する受容体が備わっており、それにより、体内に病原体のような異物が侵入してきた際に、異物であると認識し、排除しようとするシステムが稼働することが知られている(自然免疫)。
「Nod-like receptors(NLRs)ファミリー」に属する「NLRP3」は、そうした受容体の1つで、細胞内のパターンを認識し、ウイルス、細菌、環境中の刺激物(シリカやアスベストなど)、死細胞から放出されるATP、痛風の原因となる尿酸結晶などによって活性化することが知られているほか、活性化するとアダプタータンパク質「ASC」や未成熟型のカスパーゼ1とともにタンパクの質複合体「NLRP3インフラマソーム」を形成することが知られている。
NLRP3インフラマソームにより活性化したカスパーゼ1は、細胞質中の未成熟型のサイトカイン(インターロイキン1β、インターロイキン18)を切断し、サイトカインの細胞外への分泌を促進するが、これまでの研究から、インフルエンザウイルスが細胞に感染すると、細胞内のNLRP3インフラマソームが活性化して炎症反応を引き起こすこと、ならびに、同炎症反応がインフルエンザウイルス特異的免疫応答の誘導に必要であることなどが報告されてきた。
しかし、ウイルス感染以外の研究分野では、ATPや尿酸結晶によって細胞を刺激した際のNLRP3インフラマソームの活性化には、ダメージを受けたミトコンドリアが産生する活性酸素種(ROS)が重要であることが報告されていたものの、ウイルス感染によって細胞内のNLRP3インフラマソームがどのように活性化するか、その分子機構についてはよく分かっていなかった。
そこで今回、研究グループは、ウイルス感染によるNLRP3インフラマソームの活性化にもミトコンドリアが産生する活性酸素種(ROS)が必要かどうかを確かめることを目的に、ミトコンドリアROSだけを阻害する薬剤存在下でのNLRP3インフラマソームの活性化(インターロイキン1βの産生)を調査。その結果、ミトコンドリアROSの産生を阻害する薬剤存在下でもウイルス感染によってNLRP3インフラマソームが活性化していることを突き止めた。
また、ウイルス感染によるNLRP3インフラマソームの活性化にそもそもミトコンドリアは必要であるか否かを調べることを目的に、ミトコンドリアDNAを脱落させた細胞にウイルスを感染させ、NLRP3インフラマソームの活性化を解析したところ、ミトコンドリアDNAを脱落させた細胞では、ウイルス感染後のインターロイキン1βの産生やカスパーゼ1の活性化が低下していることを確認。この結果から、NLRP3インフラマソームの活性化と炎症誘発性サイトカイン(インターロイキン1β)の産生により炎症反応が起こる過程で、ミトコンドリアが何らかの働きをしているとの推測を得るに至ったという。
そこで、同ミトコンドリアDNAが脱落した細胞で何が起こっているのかを調査。その結果、この細胞ではミトコンドリアの膜電位が低下していることを確認。この膜電位とウイルス感染によるNLRP3インフラマゾームの活性化の関連性を調べるために、さらにミトコンドリア同士の融合に関わる「mitofusin(Mfn)タンパク質」を欠損させた細胞を観察。これまでの研究から同細胞では、ミトコンドリア同士の融合が起こらずに、細胞質中に断片化したミトコンドリアが多く観察されること、ならびに断片化したミトコンドリアでは、膜電位の低下が認められることが分かっていたことから、ウイルス感染後のNLRP3インフラマソームの活性化におけるMfnの役割に着目して実験を進めたところ、インフルエンザウイルス感染により、細胞内のNLRP3がミトコンドリアの外膜タンパク質であるMfn2に結合することを見出したほか、Mfn2の発現を低下させた細胞に、インフルエンザウイルスを感染させたところ、インターロイキン1βの産生やカスパーゼ1の活性化が低下していることが判明したとする。
これらの結果、ミトコンドリア外膜上でNLRP3とMfn2が結合することは、インフルエンザウイルス感染によるNLRP3インフラマソームの活性化に必要であること、ならびにNLRP3インフラマソームはミトコンドリア外膜に存在するMfn2を足場にして活性化していることが示唆されたと研究グループでは説明しており、このことは、ミトコンドリアは単にエネルギー産生の場としてだけでなく、ウイルス感染による炎症反応のシグナル伝達の中心として機能していることを示す重要な発見になるとする。 なお、研究グループでは、今回の知見を活用することで、ウイルス感染後の過剰な炎症を抑えるような治療薬の開発や炎症を起こさせることによりインフルエンザワクチンの効果を高めるような物質(アジュバント)の開発が期待できるようになるとコメントしているほか、NLPR3インフラマソームは、ウイルス感染症のみならず、アスベストによる肺線維症や肺がん、過食によって体内に蓄積した尿酸結晶が引き起こす痛風にも関わることが知られていることから、それらの分野にも役立つ可能性が高いとしている。