北海道大学(北大)は10月9日、宮崎大学、大阪大学(阪大)との共同研究により、「サイトカイン」の1種である「インターフェロン(IFN)」で細胞を刺激すると、IFN受容体が分解されることでIFNの効果が限定されてしまうが、「JAB1」というタンパク質分解系を調節する分子が、IFN受容体の分解を抑制することを発見したと発表した。
成果は、北大大学院 薬学研究院の室本竜太 助教、同・中嶋麻衣子氏、同・平島洸基氏、同・平尾徹氏、同・今重之助教、同・松田正教授、宮崎大医学部の下田和哉教授、阪大大学院 医学系研究科 医学専攻の織谷健司 准教授らの研究チームによるもの。研究の詳細な内容は、日本時間9月17日付けで生物学分野の科学誌「The Journal of Biological Chemistry」に掲載された。
生体内の細胞は、ウイルスなどの病原体の侵入や腫瘍細胞の増殖に対抗して、細胞間でやり取りされる多様な生理活性を持つ液性タンパク質のサイトカイン、その中でも「インターフェロン(IFN)」を特に産生する。IFNは抗ウイルス因子としてウイルス増殖の阻止や腫瘍細胞増殖の抑制だけでなく、免疫系および炎症の調節などの働きを有し、生体の恒常性維持に重要な分子だ。IFNはすでに臨床の場において、抗ウイルス薬や抗がん剤として広く使用されている。
IFNの種類としては特にタイプI型(「IFN-α」、「IFN-β」など)と、タイプII型(「IFN-γ」)が知られており、それぞれの作用は特異的受容体(I型およびII型)を介した細胞内信号伝達によって発揮される。またIFN受容体は、I型およびII型の両者とも2つ以上の異なるサブユニットから構成されている(I型IFN受容体は「IFNAR1」と「同2」、II型IFN受容体は「IFNGR1」と「同2」)。
IFN受容体は、IFNの作用を発揮するための信号伝達のためリン酸化酵素で、ヒトの細胞質内に存在するタンパク質の「ヤーヌスキナーゼ(JAK)」ファミリー(「JAK1」、「JAK2」、「JAK3」、「TYK2」の4種類)を利用する。特にI型IFN受容体のIFNAR1サブユニットはJAKファミリーの1種であるTYK2タンパク質と結合し、IFNAR2サブユニットはJAK1タンパク質と結合する。
IFNの結合によってIFN受容体が活性化されると、受容体サブユニットが「二量化」し、TYK2とJAK1が自己リン酸化により活性化し、さらに転写因子「STAT」タンパク質(「STAT1」、「STAT2」)をリン酸化して活性化する仕組みだ。ちなみに二量化とは、2つの同種の分子やサブユニット(単量体)が物理的・化学的な力によって複合体となったものを二量体といい、それを形成することをいう。
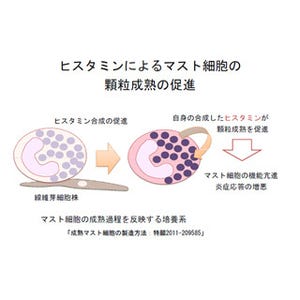
リン酸化されたSTAT1とSTAT2タンパク質は「IRF9」タンパク質と共に複合体「ISGF3」を形成し、ISGF3複合体は核内に移動してDNA上に存在する「ISRE(IFN-Stimulated Response Elements)」に結合することで、IFN活性化遺伝子群(プロモータにISREを含有)の転写を誘導する(画像1)。IFNの信号伝達系における活性化制御機構の解明はウイルス感染やがんの治療薬開発に向けて、重要な手掛かりになると考えられるという。
IFN受容体タンパク質の量は、細胞のIFNに対する応答性を規定する要因の1つだ。IFN受容体タンパク質量の調節には「ユビキチン化」が役割を持つことが、これまでの研究により明らかにされている。ユビキチンとはヒト細胞内に存在するタンパク質だ。そのユビキチンを、3種のユビキチン化酵素群(ユビキチン活性化酵素「E1」、同結合酵素「E2」、同転移酵素(ユビキチンリガーゼ)「E3」)の働きにより、標的の基質タンパク質を選択的に認識して付加することをユビキチン化といい、標的のタンパク質の機能を制御する翻訳後修飾である。
ユビキチン化されたタンパク質は多くの場合分解される。ユビキチン自身もユビキチン付加を受けることもあり、その際は重合して「ポリユビキチン鎖」を形成する。ポリユビキチン修飾されたタンパク質は「プロテアソーム」により認識され、タンパク質分解を受ける仕組みだ。
また、3種の酵素の内のE3は選択的な基質識別を担う分子であることから、その活性制御メカニズムは詳細に解析されている。中でも「Cullin型」の多サブユニットからなるE3はユビキチン様タンパク質である「NEDD8タンパク質修飾(NEDD8化)」によって活性化され、一方で脱NEDD8化酵素としての働きを持つ「COP9シグナロソーム(CSN)複合体」によって抑制される仕組みだ。
研究チームが今回同定したのが、IFN信号伝達に重要なTYK2タンパク質と結合するタンパク質のJAB1だ。JAB1タンパク質はCSN複合体を構成する8つのサブユニット(「CSN1」~「CSN8」)の1つである「CSN5」であり、E3の活性抑制に関わることから、今回の研究ではIFN信号伝達においてJAB1を介した転写翻訳後修飾(NEDD8化)調節がどのように働くかが検討された。
酵母細胞を使用する系として開発された、細胞内におけるタンパク質‐タンパク質相互作用を調べる手法の1つである「酵母ツーハイブリッド法」により、新規TYK2結合タンパク質としてJAB1を同定。ヒト子宮頸がん細胞「HeLa細胞」内でも両者が結合することを、細胞内におけるタンパク質‐タンパク質相互作用を調べる手法の1つ「免疫沈降法」や蛍光顕微鏡観察により確認が行われた。
HeLa細胞をIFN刺激するとSTATのリン酸化や活性化、IFN誘導性の遺伝子発現が観察される。その際のJAB1の関与を調べるため、「siRNA」(特殊な2本鎖構造をした短いRNA)により内在性JAB1発現を低下させたHeLa細胞を用いて、STATのリン酸化や活性化、IFN誘導性の遺伝子発現への影響を「ウエスタンブロット法」、「ルシフェラーゼアッセイ」、「Real-time PCR法」により検討した。
なおsiRNAは、適切な塩基配列のものを選択して用いると、特定のRNAの機能を抑制することができ、これを用いてさまざまな遺伝子の機能を解析できることが特徴だ。またウエスタンブロット法は抗原抗体反応の高い特異性を利用して、タンパク質混合物から特定のタンパク質を検出する手法である。そしてルシフェラーゼアッセイは、ルシフェラーゼ遺伝子産物の発光を利用し、遺伝子の転写活性を制御するプロモータ活性を調べる手法だ。最後のReal-time PCR法はDNAを増幅できるPCR法を利用し、細胞や組織内における遺伝子発現を解析する手法である。
またウエスタンブロット法を用いる形で、IFN活性を担うIFN受容体タンパク量へのJAB1発現低下による影響も検討された。さらにJAB1がIFNシグナルに対して影響を与える分子メカニズムを検討するため、JAB1を構成成分とするCSNの脱NEDD8化作用に注目し、JAB1発現低下およびNEDD8発現低下でIFN受容体タンパク量への影響をウエスタンブロット法で検討すると共に、合成NEDD8化阻害剤を用いてIFN受容体タンパク量、IFN誘導性下流信号伝達分子の活性化および遺伝子発現、さらにIFNによる抗ウイルス活性やHeLa細胞の増殖抑制作用への影響を検討した。また、 合成NEDD8化阻害剤のIFN受容体タンパク量への影響を種々のヒト腫瘍細胞株や正常細胞を用いて検討した。
ヒト子宮頸がん細胞HeLa細胞内でTYK2とJAB1は特異的に結合。さらにHeLa細胞において、siRNAにより内在性JAB1タンパク質量を低下させると、IFN誘導性のSTATのリン酸化や活性化、IFN誘導性の遺伝子発現も低下することが確かめられた。また、JAB1低下によりIFN活性を担うIFN受容体タンパク量も低下したのである。
さらにJAB1低下では、JAB1を構成成分とするCOP9シグナロソーム(CSN)の脱NEDD8化作用が低下し、IFN受容体タンパク量も低下。一方、NEDD8発現低下では、IFN受容体タンパク量の増加(分解低下)が観察された。そして合成NEDD8化阻害剤を用いた実験においても、IFN受容体タンパク量の増加(分解低下)やIFN誘導性下流信号伝達分子の活性化および遺伝子発現、さらにIFNによる抗ウイルス活性、HeLa細胞の増殖抑制作用の増強が観察されたのである。また、種々のヒト腫瘍細胞株や正常細胞において合成NEDD8化阻害剤によるIFN受容体タンパク量の増加(分解低下)も観察された。
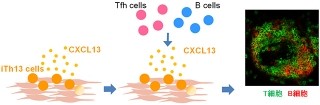
以上の結果から、JAB1はタンパク質の転写翻訳後修飾(NEDD8化)を介してIFN機能を調節する新たなIFN信号伝達系制御因子であることが示されたというわけだ(画像2)。ウイルス感染やがんの患者のための新しい薬の開発を行う際に、JAB1タンパク質およびそのタンパク質分解系は新たな分子標的となり得ると考えられるとしている。