理化学研究所(理研)、横浜市立大学(横浜市大)、地方独立行政法人神奈川県立病院機構神奈川県立がんセンターの3者は9月12日、細胞の防御反応に関わる遺伝子「NRF2」の「一塩基多型(SNP)」を調べることで、肺がん患者の予後と女性非喫煙者の肺腺がんリスクを予測できる可能性を臨床研究によって見出したと共同で発表した。
成果は、理研 ライフサイエンス技術基盤研究センター 機能性ゲノム解析部門オミックス応用技術研究チームの石川智久上級研究員(横浜市大大学院 医学研究科 客員教授)、同・岡野泰子客員研究員(横浜市大大学院 医学研究科 特任講師)、同・統合生命医科学研究センター 国際ゲノム連携研究チームのLee Ming Ta Michaelチームリーダー、横浜市大大学院 医学研究科の根津潤研究員(理研客員研究員)、同・棗田豊 教授、同・大学附属市民総合医療センターの金子猛教授(理研客員主幹研究員)、同・森田智視 教授、同・田栗正隆助教、同・市川靖史准教授、および神奈川県立がんセンターの中山治彦 副院長、同・横瀬智之部長、同・宮城洋平部長らの研究チームによるもの。研究の詳細な内容は、日本時間9月12日付けで米オンライン科学誌「PLoS ONE」に掲載された。
日本の肺がん死亡率は近年増加傾向を示しており、特に高齢者ではこの傾向が顕著だ。肺がんは、「小細胞肺がん」と「非小細胞肺がん」に大別される。小細胞肺がんと、非小細胞肺がんに属する「扁平上皮がん」は、喫煙との関係が大きいという。
一方、代表的な非小細胞肺がんの1つが肺腺がんだ。肺の腺細胞(気管支の「線毛円柱上皮」、「肺胞上皮」、気管支の外分泌腺など)から発生するがんで、非喫煙者の女性に発生する肺がんの主流となっているが、その原因はよくわかっていない。
転写因子であるNRF2は、親電子性物質、活性酸素、小胞体ストレスや血流などによるずり応力によって活性化され、活性酸素に反応して抗酸化遺伝子の発現を制御するなど、高等動物の酸化的ストレスに対する生体防御反応に重要な役割を担う。またNRF2は、薬物代謝酵素、薬物トランスポーター、抗酸化タンパク質などの遺伝子の上流に存在する「抗酸化剤応答配列(ARE)」へ別の転写因子「small MAF」と共に結合することで、遺伝子の発現を亢進して、生体防御機構を強化するといった仕組みも知られる。
さらにそれらに加えて、がん細胞の増殖や抗がん剤への抵抗性にも関わるのがNRF2だ。また、過去の研究からNRF2遺伝子の上流域に存在するSNP「-617C>A」(画像1)が、NRF2遺伝子の発現に影響を及ぼし、酸素中毒による急性肺障害のリスクと関係することが示唆されている。しかし、このSNPが臨床上有用な情報となるかどうかは明らかではなかった。そこで研究チームは、NRF2が喫煙などによる肺がんリスクの個人差に関係しているのではないかと予想し、肺がん患者におけるNRF2遺伝子の多型解析を計画したのである。
神奈川県立がんセンターで治療を受けた肺がん患者の内、インフォームドコンセントを得られた日本人387人(男性221人、女性166人)の血液試料からDNAが抽出され、理研と横浜市立大学が開発した「等温核酸増幅」(複数の酵素を組み合わせて、摂氏60度でゲノムDNAにコードされた特定の遺伝子を特異的に増幅して検出する簡便・迅速・安価な新しい遺伝子検出技術)を用いて1時間以内で解析できる遺伝子多型解析法を利用し(画像2・3)、患者のゲノムDNAのSNP(-617C>A)が、ホモ接合体「-617A/A」、ヘテロ接合体「-617C/A」、野性型ホモ接合体「-617C/C」のいずれであるかが調べられた。
なおホモ接合体とは、ヒトの体細胞は、父親と母親の両方から受け継いだ遺伝子情報(対立遺伝子またはアレル)を「対」として持っており、その対立遺伝子の情報が同一の場合をいう。2つの対立遺伝子が両方とも同じSNPを持つ場合には「SNPホモ接合体」となる。ヘテロ接合体は、一方の対立遺伝子にSNPがあって、もう片方の対立遺伝子にはSNPがない場合をいう。
|
|
|
|
NRF2遺伝子のSNP(-617C>A)の迅速検出(画像2(左))と従来シーケンス法の結果(画像3)の例。今回の研究で開発された手法を用いると、患者の血液試料やゲノムDNAからSNPを1時間以内で検出でき(画像2)、その解析結果は、従来のシーケンス法の結果と一致する(画像3の矢印) |
|
さらに、患者の臨床データ(性別、年齢、喫煙歴、肺がんの種類と進行度、生存期間など)とSNPの関連解析も行われた。その結果、SNP(-617C>A)の出現頻度は男女で差があり、SNPホモ接合体(-617A/A)を持つ女性の肺がん患者数比率は、男性の約4倍だった。特に非喫煙者の肺腺がん患者(140人)の内、SNPホモ接合体(-617A/A)を持つ患者は16人で、その全員が女性だった。
さらに、この女性非喫煙者のがん組織において、多くの固形がんで高頻度に発現し、過剰発現はがんの悪性度や予後と関連する「上皮成長因子受容体(EGFR:epidermal growth factor receptor)」遺伝子の変異が頻繁に見られることも判明した。なおEGFRは、細胞の増殖や成長を制御する上皮成長因子(EGF)を認識し、シグナル伝達を行うチロシンキナーゼ型受容体で、細胞膜を貫通して存在する分子質量170kDa(キロダルトン)の糖タンパク質だ。これまで、肺腺がんを含む非小細胞肺がんでのEGFR遺伝子変異の頻度は、欧米人に比べて日本人で有意に高いことが報告されていたが、NRF2遺伝子のSNPとの関係が示されたのは今回の研究が初めてである。
次に、NRF2遺伝子のSNP(-617C>A)と肺がん患者のがん進行度および治療後の生存率の関連について解析が行われた。その結果、SNPホモ接合体(-617A/A)を持つ肺がん患者(24人)は、がんの進行度の早期(病理病期I期:22人、同II期:2人)に限定されており、外科手術の適応とならない重度の病期まで進行した症例は1つもなかったのである。しかも手術成績は良好で、術後約5年間にわたり、ほかの死因で亡くなった1人以外の残り23人の患者は存命だ(画像4・赤の線)。
一方、ヘテロ接合体(-617C/A)または野性型ホモ接合体(-617C/C)を持つ肺がん患者(363人)は、病理病期が進行して(III期もしくはIV期)、5年生存率はSNPホモ接合体(-617A/A)の肺がん患者に比較して低く、特にヘテロ接合体(-617C/A)を持つ患者の5年生存率は30%だった(画像4・緑の線)。これらの結果から、NRF2遺伝子をSNPホモ接合体(-617A/A)として持つ患者は、肺がんの進行度が緩やかであるため、患者の予後が良好である可能性が示唆されたというわけだ。
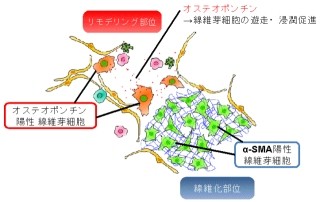
さらに、NRF2遺伝子のSNP(-617C>A)と、がん細胞の増殖や細胞死に関わるほかの遺伝子多型との関係が調べられた。その結果、SNPホモ接合体(-617A/A)を持つ肺がん患者は、腫瘍の形成を促進するがん遺伝子「MDM2」のSNP「309T>G」を持つ頻度が低く、野生型MDM2遺伝子を持つ割合が高いことが判明。正常なMDM2タンパク質は、がん抑制遺伝子「p53」を介して細胞の増殖を制御することが知られている。従って、NRF2遺伝子SNPホモ接合体(-617A/A)と野生型MDM2遺伝子は、がんの進行抑制に対して協調的に働いている可能性が考えられるという(画像5)。
画像5。石川上級研究員らの提案する分子機構。NRF2タンパク質は、酸化的ストレス、親電子化合物、およびリン酸化刺激などによって「KEAP1」から解離して核に移行する。そして、NRF2遺伝子の上流域「ARE-like」にあるSNP(-617C>A)に結合し、自身の転写を活性化。従って、上流域に存在するSNP(-617C>A)は、NRF2の自己活性化を介してMDM2遺伝子や多剤耐性トランスポーター「ABCG2」などの発現レベルを調節している可能性があるという。ABCG2は、EGFRに対する分子標的薬「ゲフィチニブ(Gefitinib)」を細胞の外に排出する働きを持つため、NRF2によるABCG2の発現上昇はがん細胞の多剤耐性獲得につながる可能性もあるとした。
またMDM2遺伝子の発現は、第1イントロンにあるSNP(c.309T>G)によって亢進すると考えられている。MDM2タンパク質はがん抑制遺伝子の産物であるp53タンパク質の分解を促進するので、MDM2遺伝子の過剰発現はがん組織の増殖、ひいてはがん患者の予後の悪化につながると考えられるという。一方、NRF2遺伝子のSNP(-617C>A)と野生型のMDM2遺伝子の組み合わせでは、p53のがん抑制効果により予後が良好となっている可能性があるとしている。
肺がんの死亡率が高い理由の1つは、発見時にすでにがんが進行していることが多いためだ。今回、NRF2遺伝子のSNP(-617C>A)と肺がん患者のがん進行度および治療後の生存率との関係を示唆したことで、このSNPが肺がんの予後ならびに非喫煙女性の肺腺がんリスクを予測するための臨床上有用なバイオマーカーになると考えられる。
NRF2が肺がんの進行に関わる仕組みはまだ解明されていない。ただし、石川上級研究員らは、NRF2遺伝子のSNPが野生型(-617C)の時、MDM2遺伝子のSNP(309T>G)との組み合わせで、がん抑制遺伝子p53の機能を低下させる機構を提案しているという。さらに、NRF2遺伝子のSNP(-617C>A)が多剤耐性に関与する抗がん剤排出トランスポーターABCG2の発現レベルを調節する分子機構についても(画像5)、今後詳細な検証を行う予定とした。
また今回の研究で用いられた、患者の血液試料やゲノムDNAからSNPを迅速(1時間以内)に検出する新しい技術(画像2)は、今後臨床の現場で、個別化医療を推進するライフサイエンス技術として期待できるとしている。