北海道大学(北大)は8月20日、ヒトの免疫を逃れ、数十年規模の長期にわたって感染し続け、肝がんの原因にもなることが知られているC型肝炎ウイルスが、どうやって免疫応答を逃れているのかに関する仕組みの一部を解明したと発表した。
同成果は同大大学院医学研究科の押海裕之 講師、宮下萌子氏、松本美佐子 准教授、瀬谷司 教授らによるもの。詳細は「PLoS Pathogens」に掲載された。
C型肝炎ウイルスは、肝がんの原因の約70%を占めると言われている。その背景として、同ウイルスがヒトの免疫から逃れる仕組みを持っており、数十年規模の長期間、ヒトに感染し続けるという点が挙げられるが、この免疫を逃れる仕組みについては、まだ十分な解明に至っていない。
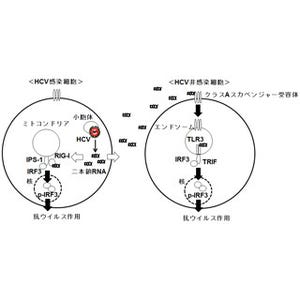
通常であれば、何らかのウイルスがヒトの細胞に感染すると、自然免疫応答がウイルスを排除しようと働く。C型肝炎ウイルスの場合、ヒトの細胞内のRIG-Iタンパク質が活性化し、それによりウイルスのRNAが認識され、強い抗ウイルス作用を持つインターフェロン(I型)の産生が誘導され、インターフェロン(I型)を受け取った細胞が、細胞中で、ウイルスRNAを分解するRNaseLなどのタンパク質を発現し、C型肝炎ウイルスのRNAを分解することで、ウイルスを排除するという流れとなる。

|
|
ウイルスが感染すると、ヒトの細胞内にウイルスのRNAやタンパク質が現れる。ヒトの細胞内でウイルスを認識するセンサであるRIG-Iタンパク質がRNAを発見すると、Ripletタンパク質が活性化し、それによりウイルスを抑制するインターフェロン(I型)の産生が誘導され、ウイルスを抑制する |
しかし、C 型肝炎ウイルスには、これらの自然免疫応答を逃れ、持続感染するために、RIG-Iタンパク質によるインターフェロン産生の誘導を抑制する能力を持ち、中でもC型肝炎ウイルスのタンパク質「NS3-4A」が、RIG-Iタンパク質からのシグナルを核へと伝える役割をするIPS-1タンパク質を分解することがこれまでの研究から報告されていた。
しかし、持続感染しないA型肝炎ウイルスも同様にIPS-1タンパク質を分解することが知られており、IPS-1タンパク質の分解という機構だけで、C型肝炎の持続感染や肝がんに至るメカニズムの説明ができないことが問題となっていた。
そこで研究グループは今回、そうした機構解明に向け、C型肝炎ウイルスと、ヒトの肝臓由来細胞および遺伝子改変マウスを用いた研究を実施したほか、試験管内実験として、精製したC型肝炎ウイルスのNS3-4Aタンパク質と、研究グループがこれまでの研究から発見していたC型肝炎ウイルス感染時のRIG-Iタンパク質の活性化に必要なタンパク質「Riplet」を精製したものを用いた実験を行ったという。
その結果、C型肝炎ウイルスのNS3-4Aタンパク質が、Ripletタンパク質の機能において重要な部位を分解することが確認されたほか、ヒトの肝臓由来の細胞と、C型肝炎ウイルスを用いて、人為的にRipletタンパク質の量を減少させたところ、細胞がC型肝炎ウイルスに感染しやすくなることを発見したとする。
また、C型肝炎ウイルスが持続的に感染しているヒトの肝臓由来の細胞では、実際にRiplet タンパク質の量が大きく減少していることも発見しており、研究グループでは、C型肝炎ウイルスが持続感染時に、Ripletタンパク質を分解することでインターフェロン(I型)の産生を抑制していることを示すものであると説明している。
今回の成果は、これまで謎とされていたC型肝炎ウイルスが、なぜ持続感染が可能であるのかについてのメカニズムの重要な部分を解明するものであり、研究グループでは今後、さらに研究を進めることで、Ripletタンパク質の分解を抑える薬剤や、Ripletタンパク質を体内で大量に発現させる薬剤をスクリーニングにより同定することで、安価で副作用の少ないC型肝炎治療薬の開発につながることが期待されるとコメントしている。