東京都医学総合研究所は、体の中で脂質に働く酵素と受容体の研究から、アレルギー発症の新しい仕組みを解明し、アレルギーの中心的役割を担う「マスト細胞」が成熟する過程において、特殊な生理活性脂質経路が働いていることを発見したと発表した。
同成果は同研究所の村上誠副参事研究員、武富芳隆主任研究員、熊本大学の杉本幸彦 教授、岡山大学の田中智之 教授、昭和大学の原俊太郎 教授、大阪バイオサイエンス研究所の裏出良博 教授、日本大学の羅智靖 教授、順天堂大学の横溝岳彦 教授、京都大学の成宮周 教授、東京大学の清水孝雄 教授らによるもの。詳細は米国科学雑誌「Nature Immunology」オンライン版に掲載された。
アレルギーは外界刺激(アレルゲン)に対する生体の過剰免疫応答の一種で、花粉症、喘息、じんましんなどが良く知られている。また、全身性に起こるアナフィラキシーショックと呼ばれる即時応答により生命に危険が生じる場合もある。
現在、日本国民の約3分の1は何らかのアレルゲンに対してアレルギーを持っていると言われており、その分子メカニズムの解明は、医学的のみならず、社会的にも重要となっている。
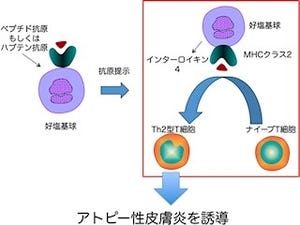
アレルギーの中心的役割を担う細胞「マスト細胞」は、細胞表面の高親和性IgE受容体がIgE(免疫グロブリンE)を介して抗原(アレルゲン)と結合すると活性化し、ヒスタミンなどの炎症性物質を放出することが知られている。マスト細胞は骨髄幹細胞より生まれた後、未成熟な前駆細胞(幹細胞から特定の細胞に分化する途中の段階にある細胞)として血管外組織に定着した後に、SCF(Stem cell factor:幹細胞因子)と呼ばれる組織微小環境由来のサイトカイン(免疫反応に中心的な役割を果たす可溶性の生理活性タンパク質)に応答して増殖するが、SCF単独ではマスト細胞の最終成熟させることができず、「プラスα」の因子が必要であると考えられてきたが、これまで、その実体は不明であった。
今回、研究グループは激しいアナフィラキシーを引き起こすハチ毒の本体であるリン脂質分解酵素「ホスホリパーゼA2(PLA2)」が、哺乳動物にも似た遺伝子「PLA2G3(3型PLA2)」として存在することから、同分子を欠損または過剰発現させたマウスを作成し、その働きを調査したところ、PLA2G3遺伝子を欠損したマウスではアナフィラキシーが著しく軽減し、逆に過剰発現マウスでは増悪することが確認された。
調査を進めた結果、酵素PLA2G3はマスト細胞内に貯蔵されており、外界からの刺激により細胞外に分泌されるが、酵素欠損マウスではマスト細胞の数は正常であったものの、形質的に未成熟でヒスタミン含量が著しく少なく、このためにアレルギー反応が起こらないことが判明した。
さらに研究グループでは、PLA2がリン脂質から脂肪酸を遊離させ、下流の合成酵素によって多種多様な脂質メディエーター(生理活性脂質)に代謝され、それぞれが特異的な受容体に作用することで様々な生命現象に関わることを受け、酵素PLA2G3の下流で機能する脂質メディエーターの同定に向け、多数の脂質メディエーターの合成酵素および受容体の欠損マウスにおけるアナフィラキシー応答を網羅的に調査したところ、脂質メディエーターの1つである「PGD2」を合成する酵素「L-PGDS」、ならびにPGD2の第一受容体「DP1」の欠損マウスが、PLA2G3欠損マウスと類似の表現型を示すことを見出した。
また、マスト細胞のPLA2G3またはDP1、あるいは間質線維芽細胞のL-PGDSが遮断されると、マスト細胞の成熟が著しく損なわれることも判明し、線維芽細胞由来のSCFの刺激によりマスト細胞から分泌されたPLA2G3は、隣接する線維芽細胞のL-PGDSを介してPGD2を産生し、このPGD2がマスト細胞上のDP1に作用することで、マスト細胞の成熟が正常に進行することが示された。
この結果、これまで不明とされていたマスト細胞の成熟に関わる未知のプラスαが、従来想定されていたサイトカインや接着分子などではなく、マスト細胞と線維芽細胞の相互作用により作動するPLA2G3(酵素)→L-PGDS(酵素)→PGD2(脂質メディエーター)→DP1(受容体)という脂質代謝経路であることが示されたこととなった。研究グループでは、同脂質代謝経路がヒトのマスト細胞の成熟プロセスにおいても作動することを確認したという。
なお研究グループは、現在のアレルギー治療薬として主流である抗ヒスタミン薬やマスト細胞安定化薬では、一度症状が出てしまうとその効果は十分とは言えず、眠気などの副作用があるが、今回発見された"マスト細胞の成熟を制御する脂質経路"を標的とした創薬により、新しいアレルギー治療薬や予防薬の開発につながることが期待されるとしている。特に、PLA2G3はゲノム上に類縁の分子が存在していないほか、特異的阻害剤が存在しないことから、新規の抗アレルギー薬の創薬標的として有望であるとしている。