大阪大学(阪大)は、神経終末部において、神経伝達物質の放出に必要とされるSNARE複合体の機能異常によって、神経細胞に局在しシナプスの可塑性や神経伝達物質の調整などを行っているたんぱくである「α-シヌクレイン」の集積が生じることを見出したほか、同所見の発現は神経細胞の種類によって違いがあることを見つけたことを発表した。
同成果は同大大学院医学系研究科情報統合医学講座(神経内科学)の望月秀樹 教授、北里大学医学部の水野美邦 客員教授(神経再生医療学講座)、同 高橋正身 教授(生化学講座)および同 阪上洋行 教授(解剖学講座)らによるもので、詳細は米国神経科学学会誌「Journal of Neuroscience」に掲載された。
α-シヌクレイノパチーは、多系統萎縮症(MSA)、レビー小体型認知症(DLB)およびパーキンソン病(PD:Parkinson's disease)などを含む神経変性疾患の総称で、その病理学的な特長は、α-シヌクレインを含むたんぱく質の凝集物が神経細胞内に集積・蓄積することとされている。しかし、その発現メカニズムについては、α-シヌクレインの発現に関与する遺伝子の異常に伴う発現量増加や特性変化などが考えられているものの、未だに十分に解明されていない。
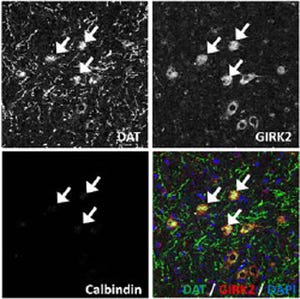
近年、DLB患者の剖検脳を用いた検討において、α-シヌクレインにより形成された凝集体の90%以上が神経終末部に存在することが報告された。神経終末部では、SNAP-25、VAMP-2、Syntaxinなどの分子から構成されるSNARE複合体によって、神経伝達物質を含む小胞とシナプス前膜との融合が起こり、神経伝達物質が放出されるほか、最近では、α-シヌクレインがSNARE複合体の制御に関与することを示唆する知見が報告されるようになってきており、こうした報告を受けて同研究グループでは今回、SNAP-25に異常を有するマウス(変異マウス)の線条体を用いて、SNARE複合体の機能異常が α-シヌクレインの存在様式に影響を及ぼす可能性についての検討を行った。
その結果、SNAP-25の異常によってSNARE複合体の機能が障害されたマウスでは、大脳皮質から線条体に投射するグルタミン酸作動性の神経終末部において、α-シヌクレインの集積が起こることを発見したものの、同所見はPDで障害を受ける黒質から線条体に投射するドーパミン作動性の神経終末部には認められなかったとのことで、このことからSNARE複合体の機能障害が α-シヌクレインの集積・凝集に関与すること、ならびに同所見の発現は神経細胞の種類によって異なることが判明した。
α-シヌクレイノパチーの病理学的な特徴はα-シヌクレインの集積・凝集形成であることから、これまでその原因を解明するために α-シヌクレインの発現量あるいは特性の変化に焦点を当てた研究が数多く実施されてきた。しかし、正常の内在性α-シヌクレインの集積・凝集を引き起こす因子に関する報告は限られており、今回の発見は、そうしたメカニズムにSNARE複合体の機能異常が関与することを示唆する新たな知見になると研究グループでは説明している。
また、同所見の発現の有無は神経細胞の種類によって異なっており、パーキンソン病で障害を受ける黒質由来のドーパミン作動性の神経終末部ではみられず、大脳皮質から投射したグルタミン酸作動性の神経終末部で観察されたことから、同じようにα-シヌクレインの集積・凝集が原因と考えられる疾患においても、各々で病態発現メカニズムに違いがある可能性が示唆されたともしている。
α-シヌクレイノパチーの中でも最も原因解明が進んでいない疾患であるMSAは、グリア細胞におけるα-シヌクレインの蓄積に特徴があり、何らかのメカニズムによってその凝集物が神経細胞に伝搬することで発症すると考えられている。MSA患者の剖検脳では大脳皮質の神経細胞でα-シヌクレインの蓄積が報告されており、今回の発見は大脳皮質由来の神経細胞の終末部で観察された知見であり、こうしたグリア細胞を介したメカニズムとは異なることから、MSAで報告されている大脳皮質の神経細胞でのα-シヌクレインの集積にSNARE複合体の機能異常による神経終末部でのα-シヌクレインの集積の増悪が関与している可能性があると考えられるとのことで研究グループでは今後、MSAの病態メカニズムの解明を目指し、この点に関する研究を進め検証していきたいとしている。