東京大学は7月10日、新潟大学、北海道大学と協力して、脳内マリファナ類似物質の「2-アラキドノイルグリセロール(2-AG)」の分解酵素である「モノアシルグリセロールリパーゼ(MGL)」が、小脳の「プルキンエ細胞」にある4種類のシナプスの内、「平行線維」と呼ばれる神経突起のシナプス終末と、周辺の「グリア細胞」にのみ存在することを確認したと発表した。
また、MGLを持たないマウスと正常マウスを比較したところ、平行線維シナプスだけでなく、そのほかのMGLが存在しないシナプスに作用した2-AGも、シナプスの種類に関係なく「非特異的」に分解されることがわかった。即ち、脳は2-AGの分解に関しては、大雑把な省エネ戦略をとっていることが判明したのである。
成果は、東大大学院 医学系研究科の狩野方伸(かのう・まさのぶ)教授らの研究グループによるもの。研究の詳細な内容は、7月9日付けで「米国アカデミー紀要(Proceedings of the National Academy of Sciences of the USA:PNAS)」に掲載された。
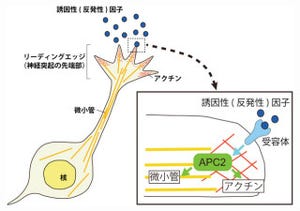
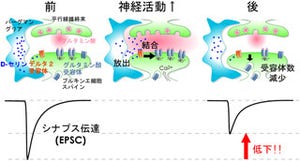
脳の神経細胞(ニューロン)の活動が高まると、マリファナに類似した物質である2-AGが作られ、シナプスに作用して神経伝達物質の放出を抑える。シナプスでは、信号を送る側(シナプス前ニューロン)の軸索(神経突起)の終末から神経伝達物質が放出され、信号を受けとる側(シナプス後ニューロン)の細胞膜にある神経伝達物質受容体に作用して情報が伝達される仕組みだ(画像1)。
一方、「内因性カンナビノイド」は、シナプス後ニューロンで作られ、シナプス前終末に存在するカンナビノイド受容体に働いて、神経伝達物質の放出を減少させて、シナプス後ニューロンへの情報伝達を抑える。
この現象は、情報の流れが通常のシナプス伝達とは逆向きなので、「シナプス伝達の逆行性抑圧」という。狩野教授らの以前の研究から、逆行性抑圧を担う内因性カンナビノイドは、細胞膜のリン脂質から作られる2-AGであることがわかっている(画像1)。しかし、2-AGが逆行性抑圧を起こした後、シナプス周辺からどのようにして取り除かれ、効果が消えるのかは不明であった。
なお、これまでの研究から、2-AGのほとんどが細胞質に存在するMGLによって分解されることは解明済みだ(画像1)。
そして今回、狩野教授らは、小脳のプルキンエ細胞において、2-AGがシナプス周辺で分解されてその効果が消える仕組みを解明した。MGLの効果を調べるため、狩野教授らは新潟大学の﨑村建司教授らと共同して、MGLを全身で欠損するノックアウトマウス「MGL-KO」とMGLを平行線維でのみ欠損するマウス「GC-MGL-KO」を作製して研究を行ったのである。
さらに、北海道大学の渡辺教授らと共同で、MGLがどこに存在するかを組織学的に調べたところ、MGLはごく限られた部位だけに存在することも確認することに成功した。
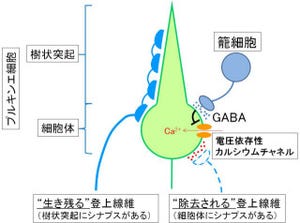
プルキンエ細胞は、平行線維、「登上線維」、「星状細胞」の軸索、「籠細胞」の軸索、という4種類の神経突起からシナプスを受けている(画像2)。この内、MGLは平行線維のシナプス前終末の細胞質に強く発現していたが、ほかの3種類のシナプス前終末には存在しなかった(画像2)。
画像2について詳しく説明する。まず小脳プルキンエ細胞(画像中央の大型の緑地に白抜きの「PC」とある細胞)には、平行線維終末(横に連なってそれが何層もある赤い「PF」)、登上線維終末(青枠に白抜きの「CF」)、星状細胞軸索終末(濃緑色地に白抜きの「SC」)、籠細胞軸索終末(淡緑色地で白抜きの「BC」)という4種類のシナプス終末が接触している。
この4種類のシナプス終末のうち、平行線維終末の細胞質だけにMGLが豊富に存在している(MGL強陽性)。これに加えて、バーグマングリア(ピンク地に黒字の「BG」)の細胞質にもMGLは弱く発現している(MGL弱陽性)。
上記4種類のシナプス終末には、いずれもカンナビノイド受容体が存在しており、プルキンエ細胞に刺激が入ると2-AGが放出され、4種類のシナプス終末からの伝達物質放出は抑圧される(画像1を参照)。平行線維終末に作用した2-AGは、自分の細胞質に豊富に存在するMGLとバーグマングリアに存在するMGLによって分解されると考えられるという。
一方、登上線維終末と星状細胞軸索終末にはMGLは存在しないが、画像2に示すように、平行線維とバーグマングリアに周囲を取り囲まれている。従って、登上線維終末と星状細胞軸索終末に作用した2-AGも、平行線維終末とバーグマングリアに存在するMGLによって分解されると考えられるのだ。
これとは対照的に、籠細胞シナプス終末は平行線維終末やバーグマングリアから離れた位置にある。このため、籠細胞に作用した2-AGはMGLによる分解を受けにくいものと考えられる。
また、神経細胞の周辺にある「バーグマングリア」にもMGLは弱く発現していた。MGL-KOでは小脳のMGLは完全に消失しており、GC-MGL-KOでは、平行線維のMGLは消失し、バーグマングリアのみにMGLが発現していたのである。
プルキンエ細胞を刺激して、細胞内のCa2+濃度を上昇させると、2-AGが放出されて、上記の4種類のシナプスにおいて、逆行性抑圧が起こった。MGL-KOとGC-MGL-KOでは、平行線維シナプスの逆行性抑圧が延長していたが、意外なことに、MGLが存在しない登上線維シナプスの逆行性抑圧も延長していることが確認されたのである。
その延長効果はGC-MGL-KOの方がMGL-KOよりも弱かったので、平行線維のMGLだけでなく、バーグマングリアのMGLも2-AGの分解に役立っており、しかもその作用は、シナプスの種類に関係ないことがわかった。
次に、星状細胞と籠細胞のシナプスの逆行性抑圧を比較したところ、星状細胞シナプスの逆行性抑圧はMGL-KOで延長していたが、籠細胞シナプスの逆行性抑圧は延長していないことが判明。
星状細胞のシナプスはプルキンエ細胞の樹状突起に存在しており、周囲を平行線維シナプス終末とバーグマングリアに取り囲まれているが、籠細胞のシナプスはプルキンエ細胞の細胞体にあって、周囲にMGLを持つ平行線維終末は存在しないので、籠細胞シナプスの逆行性抑圧はMGL-KOでも変わらなかったと考えられている(画像2)。
以上の結果から、2-AGが逆行性シナプス伝達抑圧を起こした後、2-AGは限られたシナプス終末やグリア細胞に存在するMGLによって、シナプスの種類に関係なく「非特異的に」分解されて作用を終えることがわかった。
以前の研究から、シナプス後部のニューロンからの2-AG産生と放出は、「シナプス特異的」に起こることが知られており、分解も同様に、シナプス特異的に行われるだろうと予想されていたので、今回の結果は意外だったという。
2-AGは脂溶性が高く、生体膜を比較的自由に通過できるので、MGLが存在しない登上線維シナプス終末や星状細胞シナプス終末に作用した2-AGは、周辺の平行線維終末やバーグマングリア細胞の膜を通過して細胞質に入り、そこのMGLによって分解されるのだろうと、狩野教授らは推測している。
2-AGによる逆行性シナプス伝達抑圧は、さまざまな脳機能に関与し、その作用を強めることで、抗不安作用、抗うつ作用、鎮痛作用などが得られることは確認済みだ。MGLの働きを阻害して2-AG分解を抑制することが、新たな抗不安薬、抗うつ薬、鎮痛薬の開発につながるかもしれないと、狩野教授らはコメントしている。