横浜市立大学先端医学研究センターは10月28日、「小脳萎縮と脳梁低形成を伴うび漫性大脳白質形成不全症」(HCAHC:Diffuse cerebral hypomyelination with cerebellar atrophy and hypoplasia of the corpus callosum)の原因遺伝子を発見したと発表した。横浜市立大学学術院医学群の才津浩智准教授と同遺伝学教室の松本直通教授らによる発見で、成果は米科学雑誌「American Journal of Human Genetics」に日本時間10月28日にオンライン版に掲載。
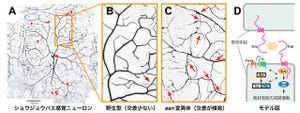
「先天性白質形成不全症」は、中枢神経系の骨髄の形成不全により大脳白質が十分に構築されないことによって起きる脳の病気で、多様な疾患が含まれるのが特徴だ。その一種であるHCAHCは、2009年に国立精神・神経医療研究センターの佐々木征行部長らが初めて報告した新しい白質形成不全症である(画像1)。
HCAHCは3歳頃から徐々に進行する歩行失調、筋肉の収縮と弛緩が繰り返される不随意な「振戦」、緩徐言語を認め、軽度から中等度の精神運動発達遅滞を呈するのが傾向である。原因は不明で、根本的な治療方法がないのが現状だ。
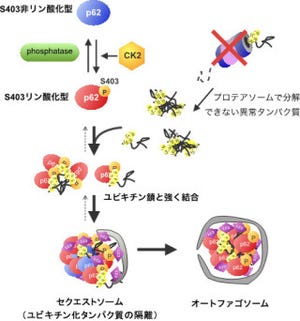
そこで研究グループでは、全エキソンシークエンスを3名の患者で実施。1名において「POLR3A」遺伝子の、2名において「POLR3B」遺伝子の「複合ヘテロ接合体」を同定した(画像1)。複合ヘテロ接合体とは、2つある遺伝子座のそれぞれに変異がある状態のことをいう。
POLR3AおよびPOLR3B遺伝子は、「RNA polymeraseIII(PolIII)複合体のコアになるサブユニット(RPC1およびRPC2)をコードしているのが特徴だ。複合体の3次元モデルの解析から、同定された変異はPolIII活性を低下させると予想された。PolIIIはtRNAと「6SrRNA」を含む大多数の低分子RNAをコードする遺伝子を転写しており、これらの低分子RNA量が不足することにより、髄鞘化不全が起きると考えられている。
今回の研究はHCAHCの原因遺伝子を明らかにしたのと同時に、髄鞘化不全の病態に低分子RNAの附属が関与しているという新たな知見を加えた。今後の髄鞘化不全の病態の解明と、治療法の開発に大きく寄与することが期待されている。