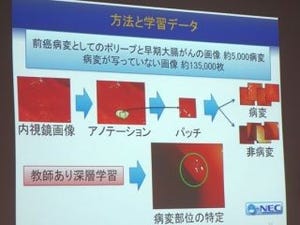
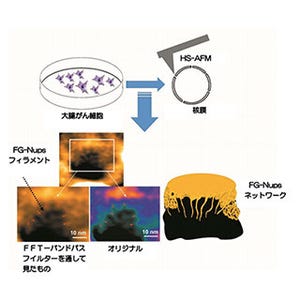
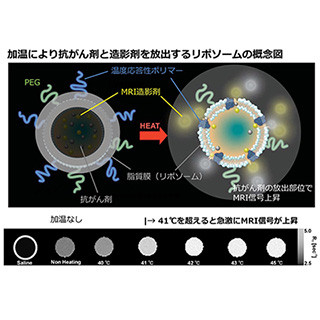
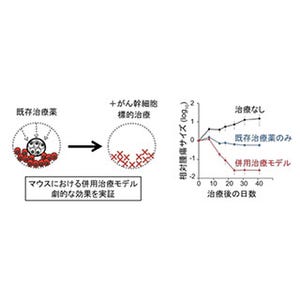
慶應義塾大学(慶大)は8月29日、100年来のがんの謎であったがんの代謝が変化する仕組みを解明したと発表した。
同成果は、慶應義塾大学先端生命科学研究所 曽我朋義教授、佐藤清敏特任助教、香川大学医学部消化器外科鈴木康之教授、国立がん研究センター谷内田真一ユニット長、愛知県がんセンター研究所青木正博部長らの研究グループによるもので、8月29日付の米国科学誌「Proceeding of National Academy of Sciences of the United States of America」オンライン版に掲載された。
がん細胞は、正常細胞と異なる代謝を使って生存に必要なエネルギーを産生していることが知られており、この現象は、1920年代にドイツの生理学者Otto Warburg氏によって発見された。近年、この代謝以外にも、がんに特異的な代謝がいくつか見つかり、がん細胞はこれらの代謝を使って増殖に必要な生体分子をつくり出していることがわかっている。
現在、がんが示す代謝を阻害してがん細胞を死滅させようとする抗がん剤の開発が世界中で行われているが、がん細胞がどのようなメカニズムで代謝を変化させるかについては、よくわかっていなかった。
今回、同研究グループは、大腸がん患者275名から採取された正常組織とがん組織に存在する生体分子について、メタボローム解析やDNAマイクロアレイを用いた遺伝子発現解析などさまざまな測定を実施。大腸がんの代謝は良性腫瘍の段階から変化しがんのステージによらないこと、がん遺伝子産物であるMYCタンパク質が215の代謝反応を介して大腸がんの代謝を変化させていることを臨床検体で証明した。
さらにMYCおよびMYCが制御している代謝酵素の抑制が大腸がん細胞の増殖を抑えること、MYCが制御しているピリミジン代謝経路が有望な大腸がんの治療法の標的になることを示した。
|
|
MYCの発現を抑制すると大腸がん細胞の遺伝子発現がリセットされる。大腸がん患者のがん組織での遺伝子(左)は、大腸がん細胞(HCT116)を用いて、MYCの発現を抑制すると、高発現の遺伝子(赤)は低発現(青)に、低発現の遺伝子(青)は高発現(赤)に遺伝子発現が反対になった。このことは、これらの遺伝子は、MYCによって制御されていることを示す (出所:慶大Webサイト) |
同研究グループは、「この成果によって大腸がんの予防法や治療法の開発が進展すればうれしい」とコメントしている。