新潟大学は2月3日、多発性硬化症および視神経脊髄炎の神経変性に関わる新たな仕組みを発見したと発表した。
同成果は、同大学 脳研究所 神経内科 河内泉 講師、西澤正豊 教授、穂苅万李子 大学院生、横関明子 医師らの研究グループによるもので、2月2日付けの米科学誌「Annals of Neurology」に掲載された。
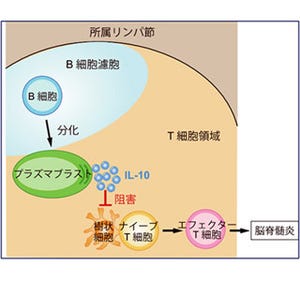
多発性硬化症(MS)および視神経脊髄炎(NMO)は、視神経や脊髄、脳に炎症が起こることで、視力の障害、手足の麻痺、しびれや認知機能障害などの症状が現れる神経難病。異常な免疫反応により、MSでは神経軸索を覆うミエリンが破壊され、NMOでは神経細胞・軸索に隣接しサポートするアストロサイトが破壊される。この結果、神経機能が重度に障害される神経変性が起こる。MSとNMOでは異なる免疫制御治療が開発されており、異常な免疫因子をある程度制御することが可能となっているが、神経を保護する治療法は未だ開発されていない。
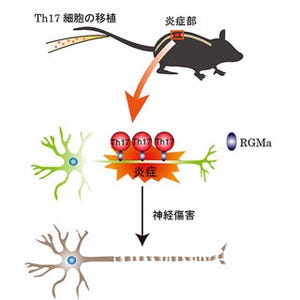
今回、同研究グループは、MSとNMOでは視力障害がしばしば起こるが、NMOではMSに比較して、より重度で回復が不良な視力障害に進展すること、MSのミエリン障害、NMOのアストロサイト障害に加え、MS・NMOともに、視神経軸索と網膜の神経細胞が強く変性していることを明らかにした。
また、MSでは「未知の異常な免疫因子」によるミエリンの破壊に引き続き神経変性が起こる一方で、NMOでは「アクアポリン4抗体」によるアストロサイトの破壊に引き続き神経変性が引き起こるが、MSとNMOで障害された神経軸索には、変性したミトコンドリアや陽イオンチャネル「transient receptor potential cation channel subfamily M member 4 (TRPM4)」が異常に集積しており、MSとNMOの神経軸索減少に関与していることがわかった。
さらに神経軸索の障害は、網膜の神経細胞にも変化を及ぼすことがわかった。特にNMOではMSと比較してより多くの異常なミトコンドリアが、変性した神経軸索に含まれるため、疾患の早期から免疫制御治療を行うことに加え、神経保護治療を追加する必要があることが示唆された。
同研究グループは、異常な免疫分子を制御する「免疫制御治療」と「神経保護治療」の組み合わせにより、患者のQOL向上が期待されるとしている。