北海道大学(北大)は12月25日、データサイエンスの最新の手法を開発し、細胞内の分子モーター「F1-ATPase」における高効率なエネルギー変換の重要な仕組みを解明したと発表した。
同成果は、北海道大学 電子科学研究所附属社会創造数学研究センター 李振風 准教授、小松崎民樹 教授、東京大学 工学研究科 応用化学専攻 野地博行 教授らの研究グループによるもので、12月17日付けの英オンライン科学誌「Nature Communications」に掲載された。
F1-ATPaseは、化学エネルギーを使って回転するモータータンパク質で、分子構造変化と複数の中間反応を巧妙に組み合わせることで、効率よく化学エネルギーを回転の力学エネルギーに変換している。この中間反応は、ATPがF1-ATPaseに結合する過程、F1-ATPaseに結合したATP(結合ATP)が加水分解してアデノシン二リン酸(ADP)が生成する過程、ADPがF1-ATPaseから解離する反応、無機リン酸が解離する反応などから構成されているが、高効率なエネルギー変換を実現するための反応順序がどのように制御されているかなどは未解決問題となっていた。なかでも、結合ATPの加水分解については、反応生成物の結合解離過程と比べて回転に必要なトルク発生への寄与が少なく、放出するエネルギーも全体から見てわずかであることがわかっていたが、結合ATPの加水分解がF1-ATPaseの反応サイクルのなかでどのような役割を果たしているのかについてはよくわかっていなかった。
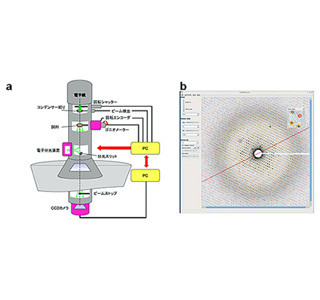
今回の研究では、F1-ATPaseの回転時系列データから回転停止時間とその間の回転角度揺らぎの統計を解析するため、ノイズの性質をできるだけ仮定しない変化点解析とファジークラスタリングを組み合わせた手法を開発。同手法とマイクロ秒時間分解能でのF1-ATPase一分子の回転観察を組み合わせて、結合ATPの加水分解反応およびリン酸解離待ちに相当する階段状の回転時系列データの回転停止プロセスの詳細な速度論に着目し、その加水分解反応が果たす役割を詳細に調べた。
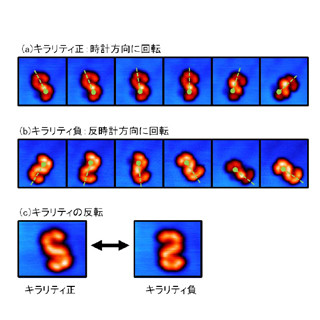
この結果、結合ATPの加水分解反応に伴って、回転停止プロセスの間に回転角度が反時計回りに20度ほど有意に変化していることがわかった。これは同反応が、回転角度の変化によりリン酸解離反応の反応障壁を大きく減少させることで、ATP加水分解→リン酸解離といった正しい反応順序を維持するための「鍵」としての役割を担っているものと捉えることができる。
「鍵」の役割を担うATP加水分解反応がリン酸解離反応の反応障壁を大きく減少させる |
この成果はF1-ATPaseだけでなく、V-ATPase、キネシン、ミオシン、ダイニンなどのモータータンパク質における高効率の分子メカニズムの解明に繋がるものと期待されている。