大阪大学(阪大)は、従来、何の役にも立たないと考えられ、炎症を起こしやすい盲腸から伸びる虫垂が、実は粘膜免疫で重要な役割を果たすIgAの産生に重要な役割を担っていることを発見したと発表した。
同成果は、同大大学院医学系研究科 感染症・免疫学講座(免疫制御学)/免疫学フロンティア研究センターの竹田潔 教授らによるもの。詳細は英国科学誌「Nature Communications」オンライン版に掲載された。
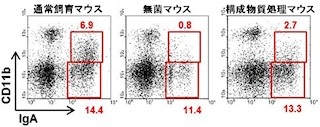
今回、研究グループは、虫垂にリンパ球の集まった場所(虫垂リンパ組織)がある点を踏まえ、そのリンパ組織の構造を典型的な腸管関連リンパ組織のパイエル板と比較して解析を実施。具体的には、免疫系が発達していない無菌マウスの虫垂を手術で切除し、虫垂切除マウスを作成した後、腸内細菌を定着させることで免疫系の発達を調べた。
その結果、虫垂を切除したマウスでは、大腸でIgA産生細胞の数の増加が顕著に遅れていることが判明。IgAは、腸内細菌叢のバランスの維持を担うことが知られていることから、虫垂切除マウスと非切除マウスの大腸の腸内細菌叢を比べたところ、虫垂切除マウスでは、大腸型の腸内細菌叢のパターンを示さないことが確認されたという。
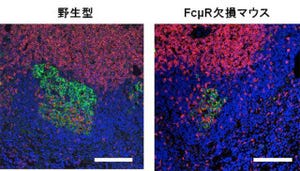
また、虫垂リンパ組織およびパイエル板のIgA陽性細胞がどこに向かうのかを調べたところ、虫垂リンパ組織のIgA陽性細胞は小腸と大腸に移動するのに対して、パイエル板のIgA陽性細胞は大腸にも移動するものの、主に小腸に移動することが判明した。
さらに、小腸および大腸へのリンパ球の動員は複数の液性因子「ケモカイン」により制御されているため、虫垂リンパ組織およびパイエル板のIgA陽性細胞のケモカイン受容体の発現を調べたところ、パイエル板のIgA陽性細胞は小腸へ導く因子が強く、大腸への因子は発現が弱いこと、一方の虫垂リンパ組織のIgA陽性細胞は小腸、大腸双方の因子を発現することが判明したという。この結果、虫垂がなくなると、大腸の腸内細菌叢のバランスが崩れることが判明したとする。
研究グループでは、今回の結果について、近年、腸内細菌叢の変化に伴い、腸管感染症に対する感受性が亢進することや、炎症性腸疾患が発症することが報告されているが、虫垂の切除による炎症性腸疾患発症感受性の変化も報告されており、今後、虫垂リンパ組織の重要性を念頭においた腸管免疫系の制御法の開発を進めることで、炎症性腸疾患や腸管感染症の治療に繋がることが期待できるようになるとコメントしている。