理化学研究所(理研)は2月19日、ノルウェー・ベルゲン大学、英・インペリアル カレッジ ロンドン、英・バーミンガム大学、オランダ・エラスムス医療センター、独・カールスルーエ大学との共同研究により、小型魚類であるゼブラフィッシュの初期胚を解析したところ、遺伝子の転写開始点が2つの異なるメカニズムによって決定され、遺伝子発現機能を持つ特別な塩基配列である「プロモータ配列」1つに対して、2つのメカニズムが独立に作用する新しい転写制御の仕組みが発見されたと発表した。
成果は、理研 ライフサイエンス技術基盤研究センター 機能性ゲノム解析部門のピエロ・カルニンチ部門長、同・ゲノミクス微量技術開発ユニットのシャルル・プレシ ユニットリーダー、同・トランスクリプトーム研究チームのアナ・マリア・スズキ技師らの国際共同研究チームによるもの。研究の詳細な内容は、日本時間2月17日付けで英科学誌「Nature」に掲載された。
細胞は状況に応じて、発現する遺伝子の種類や量を変化させる。遺伝子発現はさまざまな細胞内外のシグナルの制御を受けるが、最終的にはプロモータに基本転写因子が結合し、RNAポリメラーゼが転写開始点からRNAの合成を始めることで遺伝子の転写が開始される。
従って、細胞で発現している遺伝子の転写開始点をそれぞれ網羅的に解析し、それらのプロモータを比較した結果は、その細胞ではどのようなルールでゲノムDNAの配列が読まれ、どの遺伝子の発現が制御されているかを特定する重要な手がかりとなるというわけだ。
理研によって開発された遺伝子解析技術の1つである「CAGE(Cap Analysis of Gene Expression)法」は、少量のRNA試料からでも、「耐熱性逆転写酵素」や「cap捕捉法」を組み合わせて転写物の5'末端の塩基配列を決定でき、転写開始点を網羅的かつ1塩基レベルの正確さで、かつゲノムワイドに同定できる方法である。
CAGE法を用いて、これまでにヒト由来の細胞株などが解析済みだ。その結果、プロモータには1つの転写開始点を決めるものと、複数の転写開始点を散在させているものと2つのタイプがあることが判明している。しかし、どのように使い分けているのかはわかっていなかった。
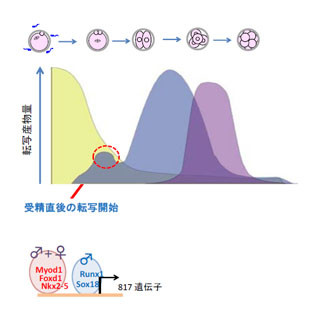
動物の発生過程では、遺伝子発現の制御が大きく変わる時期がある。卵が精子と受精した後しばらくの間は、発生は母体内での卵形成時に蓄えられた卵由来のmRNAやタンパク質の働きで進行するが、やがて受精卵(胚)に由来するゲノムDNAからの転写へ移っていく。小型魚類のゼブラフィッシュの発生では、この切り替わりは受精卵が10回目の細胞分裂を経た時期に当たり、「中期胞胚遷移(MBT:mid-blastula transition)」と呼ばれる。
今回の研究では、MBTの前後で転写されるゲノムDNAが切り替わる際、それぞれの転写開始点のパターンがどのように変化するのかがCAGE法で解析された。さらに、転写開始に影響を与えるとされる「クロマチン構造」も併せて調べられたのである。なおクロマチン構造とは、真核生物のゲノムDNAがヒストンなどのタンパク質と結合し、高度に凝縮した状態で存在する構造のことをいう。局所的なクロマチン構造の変化により、転写因子などの染色体DNAへの接近しやすさを制御する仕組みだ。
研究チームは、未受精卵からMBTを経て器官形成期にいたる12の発生段階のゼブラフィッシュ胚を用い、CAGE法でそれぞれの時期に発現する遺伝子の転写開始点を決定した。その結果、1つのプロモータからの遺伝子発現であっても、卵ゲノム由来の転写開始点と胚ゲノム由来の転写開始点が異なり、MBT前後で切り替わる例が多数見つかったのである。
また、すべての転写産物の転写量変化が調べられたところ、特にMBT前後で大きく変化するものが多いことが判明した。これは、ゼブラフィッシュの細胞内の全RNA、つまり「トランスクリプトーム」がMBTを境に大きく変化することを示している。なおトランスクリプトームとは、細胞内の全DNAの塩基配列情報を指す「ゲノム」に対し、細胞内の全転写産物、つまりすべてRNAのことをいう(その大半はタンパク質の情報を持たない「ノンコーディングRNA(ncRNA)」であり、「エピジェネティック制御」やタンパク質合成制御、幹細胞性の制御などさまざまな機能に関わる)。
画像1が、MBT前後の転写開始点を表したもの。ゼブラフィッシュの発生段階(左)と、MTB前後の転写開始点の位置(右)。ここでは、卵ゲノム由来の転写開始点(青色)と胚ゲノム由来の転写開始点(赤色)が異なる例として、「サイクリン1遺伝子(ccni)」のプロモータ領域が示されている。受精後6時間後(6hpf)のシールド期において、転写開始点の切り替わりが起きていることがわかる。
転写開始点が切り替わるプロモータの配列を詳しく調べると、卵ゲノム由来の転写開始点の上流30ベースペア(bp:塩基対)付近には塩基チミン(T)とアデニン(A)が連続して並ぶ配列「Wボックス・モチーフ(Wボックス)」があることが確認された(画像2・3)。Wボックス・モチーフは、プロモータ配列の中でも、「TTGACC」もしくは「TTGACT」の配列を持つもののことをいう(G:グアニン、C:シトシン)。
このDNA配列は転写開始を決定する機能があることが一般的に知られており、これが卵由来ゲノムに特徴的な転写開始点の選択に関わっていることが予想されたのである。実際に、プロモータからWボックスを欠損させても胚ゲノムの転写には影響はなく、卵由来ゲノムの転写開始点のみが消失することが確認された。
一方、胚ゲノム由来の転写開始点の上流にはWボックスはなく、下流50bp付近に、GとCが連続して並ぶ配列からTとAが連続する配列に変わる境界「SS│WW境界」が存在した。なお、SSのSはGもしくはCのことで、WWのWはAもしくはTのことだ。クロマチン構造の解析から、このSS│WW境界の直下流領域には、転写開始を促進する特徴的な「ヌクレオソーム構造」がMBT後に形成されることがわかったのである(画像4)。またヌクレオソーム構造とは、細胞核内では約150bpのDNAがヒストン8量体の周りを1.65回巻き付いており、その構造のことをいう。
これらの結果は、卵ゲノムと胚ゲノムの転写開始はそれぞれ異なるメカニズムの制御を受けており、MBTの前と後で1つのプロモータから異なる転写開始点が選択されるのは、2つのメカニズムがそれぞれ独立に1つのプロモータに作用している結果であることを示すという。
つまり遺伝子発現制御メカニズムの切り替えは、MBT前後で発現を変化させる遺伝子だけではなく、見かけ上は恒常的に発現している遺伝子にも適用される、卵と胚での遺伝子発現を制御する普遍的な仕組みであることが示唆されるとした。
プロモータの役割を正確にとらえるのが困難である理由の1つは、短いDNA配列の中に複雑な遺伝子発現パターンを決める情報が重層的に埋め込まれているためだ。今回の発見は、プロモータ配列の読み方を使い分ける2つの「文法」が存在することを示すものであり、プロモータの構造と機能を解読する新たな枠組みとなると期待できるとする。
また、発生過程におけるMBTの前と後のように、分化した細胞と未分化な細胞では転写制御メカニズムが大きく異なる可能性があるという。今回の手法を幹細胞やiPS細胞に応用し、未分化状態から目的とする細胞への分化過程に関わる転写開始の仕組みの解明や、転写制御メカニズムの操作による細胞の分化制御に利用できると期待できるとした。