東京医科歯科大学(TMDU)は2月4日、沖縄科学技術大学院大学(OIST)との共同研究により、加齢による骨粗しょう症の病態に重要な役割を果たす遺伝子を特定したと発表した。
成果は、TMDU 難治疾患研究所・分子薬理学分野の野田政樹教授、同・江面陽一 准教授、同・大学院 顎顔面矯正学分野の渡辺千穂特任助教、同・森山啓司教授、OISTの山本雅 教授らの研究チームによるもの。研究の詳細な内容は、2月4日付けで米科学雑誌「米科学アカデミー紀要(PNAS)」に掲載された。
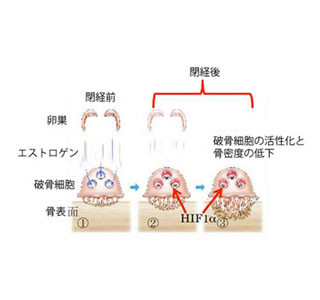
日本では高齢化社会に入り骨粗しょう症患者が増加傾向にある。現在、1200万人を超えると推定され、薬物治療の導入により欧米では減少しているにも関わらず、日本ではなお増加しており、生命予後を悪化させる大腿骨頸部骨折の主因となっている状況だ。しかし、加齢に基づく骨量減少がどのようなメカニズムで病態を引き起こすのかについて、未解明な部分が多く残っているのも。そのため、患者の症状改善や有効な治療法は未だ確立されていなかった。
研究チームは今回、近年になってメッセンジャーRNA(mRNA)の分解を促進する分子の1種として報告されている「Cnot3」に着目し、骨量減少のメカニズムに同分子が関与するのか、また同分子の候補標的の探索を実施した。その結果重要なメカニズムを見出すに至ったというわけだ。
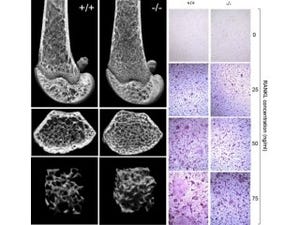
まず骨粗しょう症の仕組みを明らかにするため、加齢性の骨粗しょう症に対するCnot3の欠失の影響が調査された。マウスを用いて、高齢の2年令と若齢の4か月とを比較すると、骨量は3分の1に低下していた(画像1)、しかし、この動物では高齢の野生型(WT)に比べさらに骨量が著しく低下しており、重症の骨粗しょう症が示された。重要なこととして高齢化に伴い骨における内因性のCnot3の発現量が1/3に減少していることがわかった(画像2)。
|
|
|
|
画像1(左):野生型と遺伝子欠失型マウスの骨量低下。画像2(右):Cnot3遺伝子の骨での発現レベル。高齢では減少する(矢印) |
|
免疫蛍光顕微鏡観察によって、このCnot3分子の細胞内における存在が検討された。すると、そのタンパクは量の減少に重要な役割を果たす「破骨細胞」の核には存在せず、細胞質に存在していることがわかり、Cnot3の働きは転写の制御よりも転写後のmRNAにおける安定性の制御に関わる可能性が示された(画像3)。
そこで骨量の減少に重要な役割を果たす破骨細胞の形成と機能を促進する遺伝子「RANK」のmRNAの分解を検討した結果、Cnot3の欠失により同遺伝子のmRNAの分解が抑制されることが判明した(画像4)。以上のことから、Cnot3はRANK遺伝子の発現を抑制することにより、加齢による骨量低下を抑えていることが示され、この遺伝子が加齢に基づく骨量減少を内因性に抑止する機能を持つことを発見したのである。
|
|
|
|
画像3(左):Cnot3(緑)は破骨細胞の細胞質に存在し、核(青)には存在しない。上の列(A~C)は分化する前の破骨細胞。下の列(D~F)はRNKLにより分化させた後の破骨細胞。画像4(右):Cnot3(KO)はRNAKのmRNAの半減期を延長することにより(青矢印)、RNAKの遺伝子発現を増加させる(矢印) |
|
今回、Cnot3は加齢による骨粗しょう症の制御因子であり、内因性の防御に関わる遺伝子であることが解明された形だ。また、Cnot3の存在により加齢後の骨量維持にも効果があることを示した。今回の研究成果は、骨粗しょう症に対する新たな診断法・治療法の開発に寄与することが期待できるものと考えられるとしている。