鳥取大学は1月25日、クローニングしたRNA遺伝子に関連して発現変動する単一の「マイクロRNA」を悪性度の高い未分化がんに導入したところ、容易に悪性度を喪失させることができ、正常幹細胞へ形質転換できることを発表した。
成果は、鳥取大 医学部病態解析医学講座 薬物治療学分野の三浦典正 准教授らの研究チームによるもの。研究の詳細な内容は、1月24日付けで英オンライン総合学術誌「Scientific Reports」に掲載された。
三浦准教授は、自身のクローニングした遺伝子がRNA遺伝子であり、がんの第1抗原と目されてきた「ヒトテロメレース逆転写酵素遺伝子(hTERT)」と関連して、特に未分化なヒトがん細胞において、その発現を制御させる性質を持つ特異な遺伝子として、また発がんやがんの悪性度に関わる遺伝子として機能解析をこれまでしてきた。
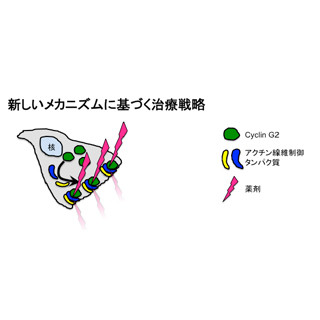
また、「未分化型悪性黒色腫」でも当該RNA遺伝子が増殖抑制できることを、製剤候補として「ハイドロゲル」や「アテロコラーゲン」を用いて確認してきた。そして今回、そのRNA遺伝子を「shRNA法」という遺伝子発現を抑制する手法により、10種程度のヒトマイクロRNAによって発現変動することが究明されたのである。そしてその1つ1つをがん細胞の中へ導入することで、最もがんを制御できる有効なものが検討された次第だ。その結果「miR-520d」が三浦准教授らが"驚異的"とも表現する現象を誘導したのである。
2012年2月に、京都大学の山中伸弥教授らが当初iPS作製に使用した「293FT細胞」、または未分化な肝がん細胞、膵がん細胞、脳腫瘍、悪性黒色腫細胞で、球状の幹細胞または「がん幹細胞様」の細胞へ容易に変化させ、その細胞は「P53」というがん抑制遺伝子を高発現していることが見出されている。それまでは、マイクロRNAのがんや再生医療の報告として、「miR-302」family、「miR-369」「200c」に関して多数種の併用でリプログラミングの試みがなされているが、1つでこのような効果をもたらす報告はなかった。
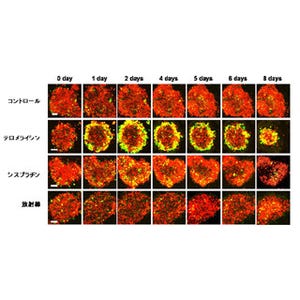
今回の研究では、まず未分化な肝がん細胞がmiR-520dにより、12時間程度でP53、Nanog、Oct4陽性の細胞へ変化し、miR-520d導入細胞がマウスでそのがんとはまったく異なる組織(奇形腫や正常肝臓組織)を形成したり、腫瘍をまったく形成しなかったりすることが確認されたのである。高分化型がんでも1カ月程度で同様の細胞へ変化することも判明した。
このことは、悪性度の高い低分化なものほど容易に良性形質になりやすいことを意味するという。この結果からメカニズムの解析が進められると同時に、治療的効果の検討も行われており、脱メチル化による脱分化誘導がその原因の1つであることが証明された。
ほかのがんでも派生元の細胞の性質をより強く持つまったく異なる細胞へ形質転換できることから、多くの未分化ながん細胞で有用な分子であることがわかったとする。たった1つの生体分子が、このように劇的にがん細胞の状態を変えてしまうことは、がん根絶の夢が目前に来ており、この領域の研究および製剤開発が推し進められることで早期に実現する可能性が高まったとした。
下の画像は、今回開発された技術の位置関係を表した模式図だ。高分化な正常細胞から、高分化ながん細胞、中分化ながん細胞、低分化ながん細胞、未分化ながん細胞が発生し、分化度の異質ながん細胞が混在することが多い。しかも、この中にはがん幹細胞が含まれている。今回の技術は、「特にがん幹細胞比率の高い未分化型がん細胞から、正常幹細胞を誘導でき、その後、生体環境に適応して分化も進む」、ということを示しているという。
医療の現場では、がん細胞は集学的に研究や治療が試みられており、がん幹細胞の根絶が困難なために、再発が担がん患者の心身を蝕んでいる。20mer(1merはDNAの塩基1個のこと)という今回の小さなRNA分子のメリットは、がん幹細胞への感受性が高いことで、ほかに治療法のない末期的な担がん状態に奏効すること、また抗がん薬で有効でなかったがん細胞にがん治療の「アジュバント療法」(メインの療法を補完するもう1つの療法のこと)として奏効する可能性が極めて高いことだ。
このRNAからなるがん細胞へ送達できる製剤との併用により、従来にない作用機序の医薬品としての応用が期待できるという。またがんに対する核酸医薬の中心的な役割を果たすことが期待できるとする。さらにP53の発現を誘導することから、再生医療でもiPS細胞の品質管理などに応用できる可能性があるとした。