東北大学は11月5日、遺伝子組換えウイルスを用いてラットの神経ネットワークの構造を調べたところ、カシューナッツのような細長い形の「海馬体」の約3分の2をなす背側の部分(背側海馬)と、残り3分の1をなす腹側の部分(腹側海馬)はそれぞれ、「梨状皮質」や「内側縫線核」、「内側手綱核」などの脳領域から入力を受けること、そしてそれら入力回路の間にはほとんど重なりが認められない、すなわち情報の干渉がなく独立していることを明らかにしたと発表した。
成果は、東北大大学院 生命科学研究科の飯島敏夫 教授らの研究チームによるもの。研究の詳細な内容は、11月5日付けで米オンライン科学誌「PLoS ONE」に掲載された。
記憶の中枢として知られている海馬は細長い構造をしており、その長軸と垂直な断面は切断箇所が違っても、金太郎飴のように、ほぼ同様な神経回路構造を含むことが知られている。ただし、その機能は長軸に沿って異なり、ヒトの海馬後部(ラットの背側海馬に相当する部位)は空間的記憶の形成に関与し、一方、海馬前部(ラットの腹側海馬に相当する部位)は情動を伴う記憶の形成に深く関わると近年、考えられるようになってきた。このような海馬の機能差を生む要因の1つとして、海馬とほかの脳領域との配線が海馬前部と後部で違う可能性が考えられるという。
しかし、従来の神経回路標識法では海馬と複数のシナプス結合を介して接続された脳の領域の結合関係については正確に調べることができなかったため、海馬を中心とした記憶を司る神経ネットワークの全容は明確にされてきなかった(画像1)。
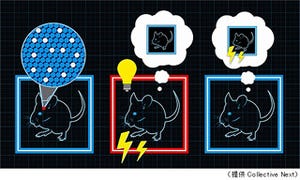
飯島教授らは遺伝子組換えウイルスを用いて、ラット海馬を中心とした神経回路を調べることにした。この組換えウイルスはニューロン選択的に侵入し、シナプスを介してニューロンからニューロンへと情報伝達の流れに逆行して神経回路内を移動し、次々にニューロンに蛍光タンパク質を発現させることにより、正確に神経連絡の実体を標識するという特徴を持つ(画像2)。
従って、海馬にこの遺伝子組換えウイルスを注入すると、海馬に情報を送る神経回路を辿っていくことができ、情報を送信している脳領域を特定できるというわけだ。さらに、異なる蛍光タンパク質(緑色蛍光タンパク:GFP、赤色蛍光タンパク:RFP)を発現させるように設計した遺伝子組換えウイルスを異なる脳領域にそれぞれ注入すると、それらの領域に入力する神経回路の関係を調べることができるのである(画像3)。
|
|
|
|
|
画像1(左):従来の神経回路標識法。シナプスを越えてニューロンからニューロンへと伝わることはできなかった。 画像2(中):遺伝子組換えウイルスを用いた、今回の神経回路標識法。シナプスを越えてニューロンからニューロンへと伝播する。 画像3(右):2種類の遺伝子組換えウイルスを用いた神経回路標識法 |
||
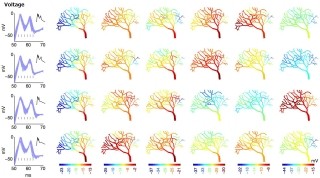
今回、腹側海馬と背側海馬のそれぞれに接続する神経回路をGFPとRFPとで別々に標識し(画像4)、それらの神経回路を使って腹側海馬と背側海馬がいかなる脳の領域から入力を受けているのか、さらに、それら2つの入力回路間には情報連絡、あるいは干渉などの可能性があるのかが調べられた。
その結果、GFPを発現するニューロンの分布とRFPを発現するニューロンの分布の間にはほとんど重なりがないことが判明(画像5)。この研究において、背側海馬と腹側海馬に入力する神経回路が並列し、独立性が高く走行していることが確認されたのである(画像6)。この並列した神経回路により異なる情報がそれぞれ背側と腹側の海馬に運ばれ、長軸方向に沿った海馬の機能差が生まれているものと考えられるという。
今回の研究が明らかにした配線図を手掛かりとして、今後新たな、海馬を中心とした神経ネットワークの機能的構造(functional architecture)の研究が展開され、それにより海馬を中心とした記憶形成メカニズムの解明が大きく進展することが期待されるとしている。
なお、飯島教授らが今回開発した標的ニューロンの機能解析を可能とする遺伝子組換えウイルスを用いて、今回同定された並列回路が記憶形成にどのように関与しているのかも検討され、その研究成果は11月7日の「PLoS ONE」に掲載される予定だ。