東京大学(東大)は、野生型のSOD1(スーパーオキシドを酸素と過酸化水素へ不均化する抗酸化酵素)は亜鉛が欠乏している環境下で変異型様の構造に変化し、亜鉛欠乏細胞の恒常性の維持に寄与していることを明らかにしたと発表した。
同成果は、同大大学院薬学系研究科薬科学専攻の一條秀憲 教授と本間謙吾 特任研究員らによるもの。詳細は「Molecular Cell」に掲載された。
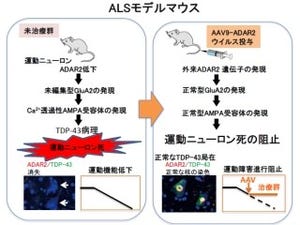
筋萎縮性側索硬化症(Amyotrophic Lateral Sclerosis:ALS)は、人生の中盤から後半にかけて発症する割合が高く、運動神経が特異的に障害される神経変性疾患である。その発症には遺伝的要因が関与しているもの(家族性ALS)があり、最も高頻度に見られる遺伝子変異としてCu/Zn superoxide dismutase(SOD1)が知られている。
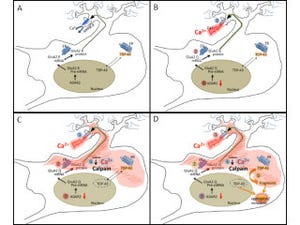
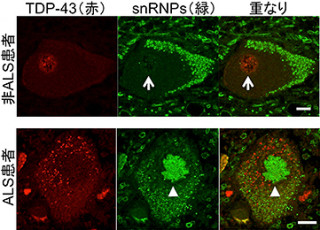
研究グループはこれまでの研究から、家族性ALSにみられる立体構造が変化した変異型SOD1は、細胞内小器官の1つで、分泌タンパク質や膜タンパク質の適切な立体構造形成に重要な働きを果たす「小胞体」に存在し、小胞体内に蓄積した不良タンパク質の分解を行うタンパク質「Derlin-1」と結合し、その働きを阻害することで、小胞体ストレスを過剰に誘導し、運動神経の細胞死を引き起こすことを報告していた。しかし、正常なSOD1(野生型SOD1)にももともとDerlin-1結合部位が存在すること、また、血清を含まない培地で培養した細胞においては、野生型SOD1でも変異型SOD1と同じように、Derlin-1結合部位を露出した構造をとることも判明しており、どのような条件において野生型SOD1の構造が変化するのか、またその生理的意義については不明のままであった。
研究グループでは今回の研究の結果、野生型SOD1の構造変化を制御する血清中の因子として亜鉛を同定するに至ったとしている。また、亜鉛欠乏時には野生型SOD1は変異型SOD1と同様の構造に変化し、Derlin-1結合部位を露出することによりDerlin-1と結合することも明らかにしたという。
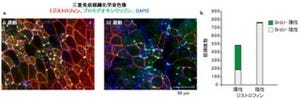
野生型SOD1には亜鉛が結合しており、亜鉛欠乏時にはSOD1から亜鉛が失われることで構造が変化する一方、亜鉛欠乏時にDerlin-1の発現を抑制した細胞では、小胞体ストレス応答が抑制され、細胞生存率が低下しており、これらの結果から、亜鉛欠乏時に野生型SOD1の構造変化によって引き起こされるDerlin-1との結合は、生理的な小胞体ストレス応答を引き起こし、シャペロンや亜鉛トランスポーターの発現を誘導したり、他のタンパク質合成を抑制することにより亜鉛欠乏細胞の恒常性と生存維持に寄与していることが示唆されたとする。
これまでの研究から野生型SOD1は抗酸化機能をもつことが知られていたが、今回の成果から、亜鉛欠乏に対抗する応答反応としての小胞体ストレスを惹起する分子スイッチとして働くことが新たに示唆されたことから、研究グループでは、今後、同成果を活用することで、鉛欠乏によって起こるさまざまな疾患に対する新たな治療薬開発につながることが期待されると説明するほか、SOD1の構造変化がALS病態に関わっていることから、SOD1の構造変化と密接な関係にある亜鉛恒常性の破綻と、ALS病態に関する研究の新たな契機になることが期待されるとコメントしている。