大阪大学(阪大)は、遺伝子活性化の目印となるヒストンH3タンパク質のアセチル化修飾を生体内で検出する方法を開発したと発表した。
同成果は、同大生命機能研究科の佐藤優子 特任研究員、木村宏 准教授らによるもの。詳細はネイチャー・パブリッシング・グループ(NPG)のオンライン雑誌「Scientific Reports」に掲載された。
ヒトをはじめとする生物は、1つの受精卵から細胞分裂と細胞分化を経て異なる性質を持つ細胞や組織、器官が形成され、個体として成り立つ。それぞれの個体は、免疫系および生殖系を除くすべての細胞が同じDNAを持っているが、どの遺伝子が働くかによって個々の細胞の性質が決定され、その役割決定にはDNAの化学修飾(メチル化など)やDNAと結合するタンパク質であるヒストンの翻訳後修飾が重要な役割を果たしていることが知られている。
「エピジェネティクス」と呼ばれるこれらのDNA配列の変化を伴わずに起こる遺伝子発現の制御において、ヒストンの翻訳後修飾の中でも、特にヒストンのアセチル化修飾が遺伝子活性化の目印として働くと考えられており、これまでの研究から、発生や分化、iPS細胞(人工多能性幹細胞)の形成過程で大きく変動することが報告されている。
また、近年の研究から、がんをはじめとする各種の疾患で、ヒストンの修飾制御が異常になることも明らかにされてきており、ヒストン翻訳後修飾を制御する細胞内の修飾酵素と脱修飾酵素を標的とした薬剤の開発も進められてきている。
しかし、GFPなど蛍光タンパク質と融合させることで、細胞内のタンパク質を培養細胞や個体で可視化できるようにはなったが、生きている生物個体の中でタンパク質の働きを調節するアセチル化やリン酸化などの翻訳後修飾の変動を検出することはできていなかった。
そこで研究グループは今回、アセチル化修飾を受けたヒストンH3を特異的に認識する抗体をもとに、蛍光プローブ「Mintbody(Modification specific intracellular antibody:修飾特異的細胞内抗体)」を作製し、モデル生物(ショウジョウバエおよびゼブラフィッシュ)の初期発生過程に導入して観察を実施。その結果、蛍光観察に成功したという。

|

|
|
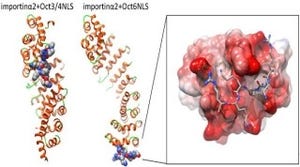
Mintbodyを用いた観察法の概要 |
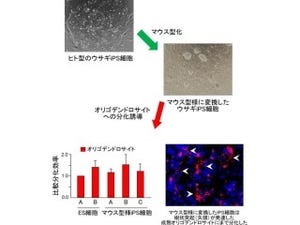
Mintbodyを用いた生物個体観察の例。(A)ショウジョウバエ初期発生において母性/胚性遷移と同時にアセチル化修飾の著しい上昇がみられた。(B)ゼブラフィッシュ初期発生過程におけるアセチル化修飾の観察に成功した |
これは、生体内で、細胞の発生や分化をつかさどる機能が、どこで、どのように活性化しているのかを生きたまま視覚的に観測できることを意味すると研究グループでは説明しており、Mintbodyを用いたヒストン修飾の生体イメージングにより、モデル動物を使った発生過程におけるエピジェネティクスの遡及的解析や、種々の疾患によるエピジェネティクス動態への影響の解明が可能になるとするほか、Mintobodyを発現する細胞やモデル動物は、エピジェネティクスを標的とした創薬に有用な研究ツールとなることが期待できるという。また、今回開発された手法は、任意のタンパク質の翻訳後修飾の生体イメージングに応用可能なため、今後の発生・再生といった生命現象の解明や抗がん剤などの創薬の促進に貢献するものと考えられるとしている。