科学技術振興機構(JST)と慶應義塾大学(慶応大)は7月16日、3つの「マウス心筋誘導遺伝子」に新たに遺伝子を1つずつ加えて「ヒト心筋誘導因子」のスクリーニングを行い、最終的に5つの遺伝子の同時導入により「ヒト心臓線維芽細胞」からiPS細胞を経ずに直接「心筋様細胞」を作製できることを明らかにしたと共同で発表した。
成果は、慶應大医学部の家田真樹 特任講師、同・和田りえ研究技術員、同・医学部小児科の山岸敬幸 准教授、同・心臓血管外科の饗庭了 准教授らの研究チームによるもの。研究はJST課題達成型基礎研究の一環として行われ、詳細な内容は米国東部時間7月15日付けで米科学雑誌「米科学アカデミー紀要(PNAS)」に掲載された。
心臓を構成する細胞を見ると、心筋細胞は全体の30%程度しか占めていない。残りの細胞の内で、全体の50%以上と最も多く占めるのが、ポンプ機能を持たず、細胞外基質や液性因子を分泌する心臓線維芽細胞だ。心筋梗塞や拡張型心筋症を発症すると心筋細胞が失われ、その部分で心臓線維芽細胞が増殖、つまり「線維化」により置き換えられ心臓ポンプ機能が低下してしまう。しかも、現時点では心臓病で一度線維化してしまった組織を元の心筋組織に戻す治療法はない。
そこで現在研究が進められているのが、iPS細胞を用いて心筋細胞まで分化させ、それを移植する手法だ。ただし、iPS細胞には現時点で腫瘍形成の可能性を完全に除去できていないほか、心臓に適した細胞移植法の開発が必要な上に、移植後に細胞が長期生着するかどうかといった問題などもある。
そこで研究チームは、幹細胞を用いるこれまでの心臓再生法とは異なる新しい心臓再生法として、臨床医として心臓組織や細胞を見てきた経験から心臓の中に存在する心筋以外の細胞である心臓線維芽細胞を心筋再生の細胞源として使うという新たな発想に基づく研究を開始した。心臓内に多数存在するこの心臓線維芽細胞を心筋細胞へと直接転換することができれば、iPS細胞を経由する幹細胞を用いた医療に伴う前述の問題点を解決できる可能性があるというわけだ。
今回の研究に先立ち、2010年に家田特任講師らはマウス心筋細胞を作り出すために必要な「心筋誘導遺伝子」(iPS細胞の「山中ファクター」に当たる)として、「Gata4」、「Mef2c」、「Tbx5」を同定することに成功している。この3つの遺伝子を培養皿上のマウスの心臓線維芽細胞に導入したところ、線維芽細胞はiPS細胞を経ることなく直接心筋様細胞(心筋細胞同様にポンプ機能のある細胞)に転換することが実際に見出された(画像1・2)。
|
|
|
|
マウスの心臓線維芽細胞から心筋様細胞の作製。同定した3つのマウス遺伝子(Gata4、Mef2c、Tbx5)を培養皿上のマウスの心臓線維芽細胞(画像1(左))に導入すると、線維芽細胞はiPS細胞を経ることなく直接心筋様細胞(画像2)に転換することが見出された。右図の強拡大像は筋肉の横紋構造 |
|
また、2012年にはマウス生体内に3つの心筋誘導遺伝子を直接導入して、心臓線維芽細胞をその場で心筋様細胞へと転換し、心筋梗塞部位に新しい心筋を再生することにも成功している(画像3・4)。しかし、今回の技術を臨床応用するために必要である、ヒトの心臓線維芽細胞から心筋細胞を直接作製することが可能かどうかは、これまで不明だった。
|
|
|
|
画像3(左):心筋直接誘導法によるマウス心筋梗塞部位の再生。マウス生体内に3つの心筋誘導遺伝子を直接導入して心臓内の線維芽細胞をその場で心筋様細胞へと転換すると、心筋梗塞部位に新しい心筋が再生した。画像4:右生体内で作製したマウス心筋様細胞 |
|
今回の研究では、最初に、ヒト心臓線維芽細胞に3つのマウス心筋誘導遺伝子をレトロウイルスベクター(細胞外から内部へ遺伝子を導入する際の「運び屋」のこと)を用いて導入することから開始。しかしマウス細胞とは異なり、心筋誘導が十分に見られなかった。
次に3つの心筋誘導遺伝子に、心筋細胞の誘導に重要と考えられた新たな11種類の候補遺伝子を1つずつ加えた計4遺伝子をヒト心臓線維芽細胞に導入して、心筋遺伝子の誘導を解析。その結果、11種類の候補遺伝子の中の「Myocd」あるいは「Mesp1」を心筋誘導遺伝子と同時に導入した時に、心筋細胞に特徴的な遺伝子の発現が上昇することが確認された。さらに、心筋誘導遺伝子に「Myocd」と「Mesp1」の両方を加えた5つの遺伝子を同時に導入することで、その効果がさらに強まることも見出されたのである。
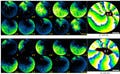
続いて、5つの遺伝子(Gata4、Mef2c、Tbx5、Myocd、Mesp1)をレトロウイルスベクターを用いてヒト心臓線維芽細胞に遺伝子導入したところ、約5%の細胞で心筋の特徴を持つタンパク質を発現するようになり、さらに心筋細胞と似た遺伝子発現様式を示すことが確認されたという。細胞の形態や構造も心臓線維芽細胞から心筋様へと変化し、細胞内部には心筋に特徴的な横紋筋構造も確認されたのである(画像5・6)。
|
|
|
|
Gata4、Mef2c、Tbx5、Myocd、Mesp1の導入により作製したヒト心筋様細胞。画像5(左):5つの遺伝子の導入により作製した心筋様細胞。画像6:ヒトES細胞から作製した心筋細胞。5つの遺伝子により誘導された心筋様細胞は、その形態や構造も心臓線維芽細胞から心筋様へと変化し、細胞内部には心筋に特徴的な横紋筋構造(強拡大像)も確認された |
|
こうして心筋様細胞の作製に成功したわけだが、それだけでは意味がない。肝心の周囲の細胞と協調して拍動できて初めて心筋細胞の代わりが務まるわけで、その確認が重要だ。実際、家田特任講師らと同様の研究を進める米国の研究チームも、2013年3月に家田特任講師らが同定した5つの遺伝子とは異なる、心筋誘導遺伝子と心筋誘導に関連する遺伝子発現を制御すると考えられるマイクロRNAを混合した6つの心筋誘導因子(Gata4、「Hand2」、Myocd、Tbx5、「miR-1」、「miR-133」)を用いてヒト心臓線維芽細胞から心筋様細胞を作製することに成功したのだが、周囲の細胞と協調して拍動が可能かなど、細胞としての詳細な生理機能が不明という問題があった。
そこで家田特任講師らは、5つの遺伝子により作製した心筋様細胞を心筋細胞と同じシャーレ上で培養し細胞の詳細な機能解析を実施。その結果、ほかの心筋細胞と一緒に培養することで心筋様細胞の成熟が進んで、周囲の細胞と協調して拍動することが確認されたのである(画像7~10)。またこのヒト心筋様細胞は心臓線維芽細胞のほか、ヒト新生児の皮膚より採取された線維芽細胞からも作製することが可能だった。
|
|
|
|
|
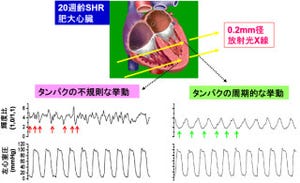
作製したヒト心筋様細胞の機能。心臓線維芽細胞から作製した心筋様細胞(画像7(左)の赤い細胞)は、ほかの心筋細胞(画像8(中)の緑色の細胞)と一緒に培養することで成熟が進み周囲の細胞と協調して拍動するようになる(画像9(右)、重ね合わせ図) |
||
|
|
|
画像10。心筋様細胞の電気活動で心筋に特徴的である |
次に、心臓線維芽細胞から心筋様細胞を誘導する際に、増殖力の高い未分化な細胞を経由していないかの検討も実施。その結果、ヒト心臓線維芽細胞は5つの遺伝子の導入により直接心筋様細胞へと分化転換し、未分化な幹細胞はその過程で誘導されないこと、また3カ月の長期間の培養でも細胞は腫瘍形成などを起こさないことが確認されたのである。
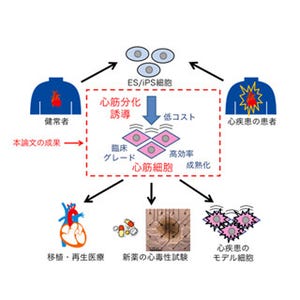
以上より、Gata4、Mef2c、Tbx5、Myocd、Mesp1という5つの遺伝子を同時に導入することで、ヒト心臓線維芽細胞からiPS細胞を介することなく直接心筋様細胞を作製できることがわかった。今回の成果は新しい心臓再生医療の実現化を進める上で重要な知見を示すものと考えるという。
今回、ヒト心臓線維芽細胞から直接心筋様細胞を作製できたことから、心臓線維芽細胞が多数存在するヒト心臓の患部に、直接遺伝子を導入するだけで心筋を再生できる可能性が出てきたという。また、これまでのiPS細胞を経由する手法と比べて工程の短縮単純化も実現しているのが特徴だ。現時点では、生体内への遺伝子導入法の確立、心筋様細胞の誘導効率の改善や安全性などの課題もあるが、今回の研究結果は心臓再生医療実現を前進させる大きな一歩であると考えられるとしている(画像11)。