横浜市立大学(横浜市大)は6月10日、国立精神・神経医療研究センター(NCNP)、水産総合研究センター(水産研)、神奈川県立病院機構 神奈川県立こども医療センター、小田原市立病院、西オーストラリア大学との共同研究により、乳幼児の筋力低下などを起こす疾患「先天性ミオパチー」の一型である、「ネマリンミオパチー」の新たな疾患責任遺伝子を発見したと発表した。
成果は、横浜市大 学術院医学群の宮武聡子特任助手、同・輿水江里子研究員、同・三宅紀子准教授、同・松本直通教授(遺伝学教室)、同・生化学教室の椎名政昭助教、同・緒方一博教授、NCNP 神経研究所 疾病研究第一部の林由起子室長、同・西野一三部長、水産研 中央水産研究所の山下倫明グループ長、神奈川県立こども医療センターの小坂仁部長、小田原市立病院の大宅喬医師(現・横浜市立みなと赤十字病院)、同・坂元祐子医師(現・横浜市立大学附属市民総合医療センター)、西オーストラリア大学のLaing教授らの研究チームによるもの。研究の詳細な内容は、日本時間6月7日付けで米科学雑誌「The American Journal of Human Genetics」に掲載された。
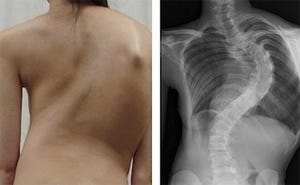
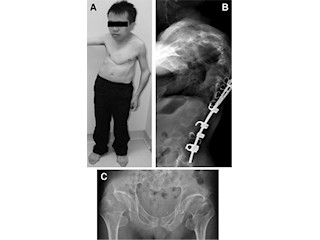
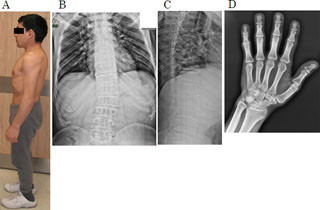
ネマリンミオパチーは先天性ミオパチーの中でも頻度の高い疾患だ。筋肉の収縮に関係する構造タンパク質が壊れるため、全身の筋力が低下を来し、凝集体「ネマリン小体」が筋線維内に出現する。これまで、いくつかの原因遺伝子が特定されてきたが、常染色体劣性遺伝形式を取り、胎児期より寡動・羊水過多など来し、出生後も呼吸不全・嚥下困難などの最重症の経過を取る重症ネマリンミオパチーの一群については、その原因は明らかではなかった。
松本教授らのグループはこれまでの研究から、ゲノムのタンパク質を決定する部分(=エクソン)をすべて解析する「全エクソーム解析」という新手法を応用し、「KLHL40遺伝子」の「複合ヘテロ接合性変異」(同じ遺伝子において、父あるいは母由来の異なる2つの変異がある状態)を発見していた(画像1・2)。

|

|
|
画像1。KLHL40遺伝子の全変異とアミノ酸の変化。1582番目の塩基置換を起こす遺伝子変異(c.1582G>A)は日本人で高頻度に同定された |
画像2。(左):KLHL40遺伝子に変異を持つ患者の筋病理像。ネマリン小体が豊富に見られる(赤矢印)。(右):電子顕微鏡で見たネマリン小体(白矢印) |
その後、日本、米国、フィンランド、オーストラリア合同国際研究を展開し、重症ネマリンミオパチーの143家系の解析で28家系(19.6%)に同遺伝子変異が見つかったことから、この遺伝子の変異が多民族にわたり重症ネマリンミオパチーの高頻度の原因となっていることを突き止めたというわけだ。
日本人では、特定の「創始者変異」(ある特定の集団内で、祖先の1人に出現した変異が受け継がれて、高頻度に認められるようになること)が存在するため、同遺伝子変異の検出率は重症ネマリンミオパチーの47家系中13家系(28%)とさらに高頻度に見られることも確かめられた。
KLHL40遺伝子によって作られるタンパク質は、筋肉の収縮に関係する構造タンパク質の1種だ。同遺伝子に変異を持つ患者では、このタンパク質が筋線維内でほとんど消失していることが確認された(画像3)。また、このタンパク質はこれまで知られているネマリンミオパチー関連タンパク質とは異なる局在を示すこともわかり、新規の分子病態を有することが示唆されたのである。
小型脊椎動物のゼブラフィッシュにおいても筋肉前駆細胞や骨格筋で同遺伝子が発現していることが確認され、「モルフォリノアンチセンスオリゴ」によって遺伝子機能を阻害すると、筋線維の構造異常が起こり、患者の病態が再現されたのである(画像4~6)。ちなみにモルフォリノアンチセンスオリゴとは、メッセンジャーRNAからの翻訳やスプライシングを抑制することで、標的遺伝子の発現を特異的に阻害するオリゴヌクレオチドのことだ。

|

|

|
|
画像4(左):ゼブラフィッシュ疾患モデルにおける筋肉への影響を解析。(左):正常のゼブラフィッシュ。(右):KLHL40遺伝子機能を阻害したゼブラフィッシュ。体幹が湾曲し小さい。画像5(中):正常のゼブラフィッシュの筋線維。画像6(右):KLHL40遺伝子機能を阻害したゼブラフィッシュの筋線維。筋線維が不均一でギャップ(右上)を生じている |
||
今回の成果に対し、研究チームは日本における重症先天性ミオパチーの早期診断、早期の適切な治療介入に貢献できる可能性があるという。またその病態解明が進めば、ネマリンミオパチーに対する新しい治療法の開発にも寄与することが期待されるとしている。