理化学研究所(理研)は1月1日、ショウジョウバエにおいて体の成長を制御するホルモンの機能を血中で調節するおとりの受容体「分泌型おとりインスリン様受容体(Secreted Decoy of InR:SDR)」を発見し、そのメカニズムを明らかにしたと発表した。
成果は、理研 発生・再生科学総合研究センター 成長シグナル研究チームの西村隆史チームリーダー、同・岡本直樹基礎科学特別研究員らの研究グループによるもの。研究の詳細な内容は、日本時間1月10日付けで米科学雑誌「Genes & Development」オンライン版に掲載される予定だ。
すべての多細胞生物は1つの受精卵から発生を経て、それぞれの種によって、体細胞の数や体積を増加させながらほぼ定められた体の大きさにまで成長し、それ以上大きくならないように制御されている。
近年、ショウジョウバエを生物モデルとした遺伝学的解析が進み、どのような遺伝子や細胞間シグナル伝達経路が関与して体全体や組織の成長を制御し、体の大きさが決定されるかについての研究が精力的に行われているところだ。
体全体の成長を制御する分泌性因子として最もよく知られているのが「インスリン様ペプチド」だ。これは、昆虫を始めとする無脊椎動物だけでなくヒトを含む脊椎動物にも広く存在している内分泌ホルモンの1つで、成長以外にも代謝や生殖など多岐にわたる生命現象を制御している重要な因子である。
ショウジョウバエのインスリン様ペプチドは、脳内の神経内分泌細胞から血中に分泌された後、細胞膜上のインスリン様ペプチド受容体を介して体や組織の成長を制御する仕組みだ。しかし、血中に分泌されたインスリン様ペプチドの機能を調節するメカニズムに関しては不明な点が多く残されていた。
そこで研究チームは、特定の遺伝子の機能を低下させる「RNAi法」を用いて、ショウジョウバエのゲノム中に存在する分泌性因子をコードする遺伝子の機能をそれぞれ低下させ、その表現型を網羅的に観察。その結果、ある遺伝子Xの機能を低下させると、体のサイズが顕著に大きくなることを発見したのである。
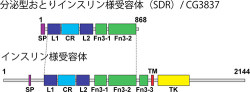
遺伝子XのDNA配列を詳しく調べると、インスリン様ペプチドを細胞表面で受け止めるインスリン様ペプチド受容体と構造が非常によく似ていたが、細胞膜貫通領域や細胞内領域を持たないタンパク質だった(画像1)。
画像1は、SDRとインスリン様受容体の構造。SDRには細胞膜貫通領域(TM)と細胞内チロシンリン酸基転移酵素領域(TK)は存在しないが、細胞外領域の構造はインスリン様受容体とよく似ている。
組織ごとの遺伝子発現や体液中のタンパク質も調べられた結果、遺伝子Xは脳神経系の「グリア細胞」から血中に分泌される分泌性タンパク質をコードしていることが判明。
次に、遺伝子Xを欠損させた変異体を作製し、体重や羽面積を経時的に測定した結果、遺伝子Xの欠損により体の成長速度が顕著に増加し、体が大きくなることがわかった。逆に、遺伝子Xを過剰発現させた変異体は顕著に体が小さくなったのである。これらの結果は、遺伝子Xが体の成長を抑制する因子であることを示すという。
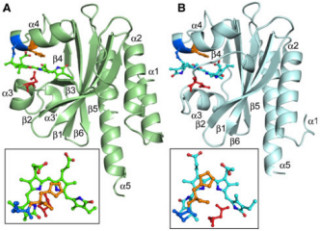
遺伝子Xがインスリン様ペプチド受容体に似ていることから、遺伝子Xからタンパク質を合成し、インスリン様ペプチドとの結合を生化学的に解析した結果、両因子は直接的に結合していることがわかった(画像2)。
さらに、遺伝子Xを欠損させた変異体と過剰発現させた変異体を用いて、「脂肪体」などの末梢組織におけるインスリン様ペプチド受容体が引き起こす「インスリンシグナル伝達経路」の活性を解析した結果、遺伝子Xの欠損により活性化し、過剰発現により活性が低下していることが明らかになった(画像3)。
画像2は、SDRの作用機序の模式図とSDR変異体の表現型。SDRは血中でインスリン様ペプチドに直接結合し、細胞膜上のインスリン様受容体への結合を阻害することにより、体の成長を抑制する。血中SDR量に応じて体の大きさが変化する。実際に、SDR欠損個体では体が大きくなり、SDR過剰発現個体では体が小さくなる。
画像3は、脂肪体におけるインスリンシグナル伝達経路の活性化状態。インスリンシグナル伝達経路の一部にある転写因子「Foxo」の細胞内局在を示す。インスリンシグナルが活性化しているとFoxoタンパク質は細胞質に存在し(野生型の通常飼育培地)、活性が下がると核内に移動する(野生型の低栄養培地)。
SDR欠損変異体では、Foxoは核内へはあまり移動せずに細胞質に存在し、またSDR過剰発現変異体では野生型よりも核に移動。これにより、SDRの機能欠損によりインスリンシグナル伝達経路は活性化し、SDRの過剰発現によりインスリンシグナル伝達経路の活性が低下していることが明らかになったのである。
これらの結果から、遺伝子Xがコードするタンパク質が血中に分泌されると、「おとり」として血中のインスリン様ペプチドに直接結合して、細胞膜上の正規のインスリン様受容体への結合を阻害し、体の成長を抑制していることが判明。研究チームは、この新しく発見した遺伝子Xを「分泌型おとりインスリン様受容体」と命名したというわけである。
ショウジョウバエの幼虫は、摂食に伴い栄養依存的に急激に成長し、幼虫期に溜め込んだ栄養をさなぎ期に使用して成虫に変態する。SDR欠損変異体の幼虫を通常の餌で飼育した場合、体が大きくなる以外に特に顕著な変化は見られない。
しかし、栄養分が極端に少ない培地で飼育すると、体が大きくなると共に、さなぎ期における致死率が顕著に上昇し、変態が完成した成虫の個体数が低下した(画像4)。
これは、SDR遺伝子の欠損により、栄養枯渇状態にも関わらず成長が促進されてしまい、栄養を貯蔵できなかったためだと考えられる。つまり、SDRは、栄養状態の変化に対して成長と栄養貯蔵のバランスを保つために必要な因子であると考えられるという。
正規の受容体の機能を抑制する「おとり受容体」の存在は、さまざまなシグナル伝達経路で知られていたが、インスリン様ペプチドに対するおとり受容体の機能と重要性は、今回の研究において初めて示すことに成功した形だ。
ちなみに、インスリンやインスリン様成長因子(IGF)などを含むほ乳類のインスリン様ペプチドにもおとり受容体が存在する可能性が示唆されているという。インスリンの異常は糖尿病を引き起こす主な原因の1つとして知られており、また、IGFの異常は、巨人症や末端肥大症などの成長疾患やさまざまながんを引き起こすことが知られている。
研究グループは、今後、ほ乳類のインスリン様ペプチドに対するおとり受容体に関する研究が進むことによって、将来的に糖尿病や成長疾患、がんなどの治療への手法開発の一助になることが期待できるとした。