理化学研究所(理研)は12月13日、「超解像顕微鏡法」を応用して25nmの分解能を実現し、細胞の中で物質輸送のレールとして働く「微小管」の先端に新しい構造領域とその機能を発見したと発表した。
成果は、理研 発生・再生科学総合研究センター 光学イメージング解析ユニットの清末優子ユニットリーダー、オランダ・ユトレヒト大学のIlya Grigoriev研究助手、米リーハイ大学のLynne Cassimeris教授による国際共同らの研究グループによるもの。研究の詳細な内容は、日本時間12月13日付けで米オンライン科学誌「PLoS ONE」に掲載された。
体の中で、ある細胞がほかの細胞たちと協調しながら細胞内外の情報を正確に伝えたり、その形や活動を決めたりするには、細胞の中の骨組みである「細胞骨格」の働きが重要とされている。
細胞骨格は、異なる機能を持つ複数の構造体で形成されており、その中でも微小管は、細胞の中で物質輸送のレールとして機能する。微小管は、「チューブリン」というタンパク質の2量体が縦方向につながった13本の素繊維が、チューブ状に束ねられた直径約25nmの繊維状構造である。側面で結合し、構造的に非対称性を持つチューブ状の中空構造を形成する。
チューブリンの構造に依存して、微小管には「プラス端」と、その反対側の「マイナス端」があり、チューブリンの付加と離脱は主にプラス端側で起こる(画像1)。
ヒトの健康や病気に関わる多くの物質が微小管を伝って運ばれるため、微小管の正しい配置はヒトの健康維持に重要だ(画像2)。微小管の向きは、微小管依存性のモータータンパク質の移動方向を決める。順行性、逆行性のモータータンパク質が正しい方向に荷物を運ぶために、微小管は正しい向きに配置される必要があるのだ。
研究グループはこれまでに、微小管のプラス端に結合するタンパク質集団「+TIPs」が、微小管の長さや配置の決定に重要な役割を果たすことを明らかにしてきた。
微小管が伸長する時、+TIPsは最先端に結合する。中でも、+TIPsの1つであるタンパク質「EB1」は、微小管先端に付加されたばかりのチューブリンだけに次々と結合するため、微小管の伸長に伴って移動する(画像3、動画1・2)。
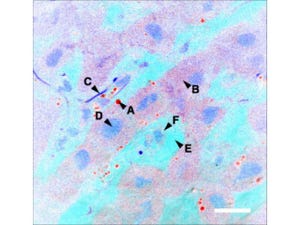
画像2は、ヒトの子宮頸(けい)がん由来の「HeLa細胞」での、+TIPsの中心的分子EB1(赤)と微小管(緑)の蛍光免疫染色画像。微小管先端の挙動や配置を決めるため、+TIPsは重要な働きをし、特にEB1は、微小管の先端だけに結合する。生きた細胞の中で標識したEB1をコマ送りで見ると、EB1は微小管が伸長する間だけその先端に集まるため、まるで彗星のように見える。
|
|
|
画像3。ヒトがん細胞由来の「HeLa細胞」での、+TIPsの中心的分子EB1(赤)と微小管(緑)の蛍光免疫染色画像(共焦点顕微鏡画像) |
|
動画1。EB1-GFPのタイムラプス動画(マウス繊維芽細胞) |
|
動画2。 EB1-GFPのタイムラプス動画(マウス筋芽細胞) |
一方、がん細胞で高発現するタンパク質「ch-TOG」も+TIPsに分類され、微小管の長さ調節に重要だ。EB1もch-TOGも微小管の先端に結合するが、これまで、それらの詳細な位置関係や役割分担はわかっていなかった。
また微小管が伸長する様式も不明で、これまでの試験管内の解析から、「付加されたチューブリンがシート状になった後にファスナーを閉じるようにして中空構造になる」、「チューブリンが螺旋(らせん)状に付加されチューブ状を保ったまま伸長する」、「チューブリンがランダムに付加されながら各素繊維がばらばらに伸長する」、などの諸説があり、結論が出ていなかったのである。特に、細胞内にある微小管の状態を詳細に観察する手段がなかった。
これらを調べるには、分子ごとに違う色で染色し、超高解像度の顕微鏡を用いて、微小管先端の構造を細胞内部で直接観察するのが有効だ。しかし、従来の光学顕微鏡では分解能200nmが限界とされていたため、さらなる分解能向上が求められていたのである。
研究グループは、近年開発された超解像顕微鏡法の1つ構造化照明顕微鏡法(SIM)を、微小管先端部の観察に用いた。SIMでは約100nmの分解能での解析が可能だ。
さらにSIM画像を基に、蛍光シグナルの最高輝度を25nmの分解能で求める画像解析手法を導入した。実際に、Hela細胞を用いて、EB1とch-TOGと微小管をそれぞれ違う色で染色し、微小管先端部分を高解像度で解析。
数100の画像を平均化した結果、ch-TOGはEB1よりも100nm以上先の部分に結合していることがわかった(画像4・5)。つまり、これまで微小管の最先端に結合していると考えられていたEB1より約100nm以上微小管は突出しており、この未知の領域にch-TOGが結合していたというわけだ。
|
|
|
|
微小管プラス端集積因子(+TIPs)の局在。画像4(左)は、SIMを用いて撮影した、微小管(緑)、EB1(白)、ch-TOG(赤)の染色像(構造化照明(SIM)画像)。ch-TOGのシグナルが、EB1よりも先端に見られる。画像5(右)は、EB1とch-TOGのシグナルの輝度分布を、微小管に沿って先端から後方に向けて解析し比較した例。ch-TOGの輝度のピークが、EB1のピークよりも約100nm先にある |
|
さらに、2012年に英国の研究グループが、EB1はチューブ状に閉じた素繊維の間に結合するという知見を得たことから、EB1よりも先の約100nmの領域では素繊維が閉じていないと予測できたという(画像6)。
画像6は、伸長する微小管先端の構造。EB1とch-TOGの結合場所と、これにより予測した伸長する微小管先端の構造が示されている。ch-TOGが伸長する素繊維の最先端に結合するのに対し、EB1は閉じた素繊維の間に結合する。
これにより、微小管の最先端部には、閉じていない素繊維がおよそ100nm(約12個のチューブリン2量体からなる)にわたって突出していることが明らかになった。EB1とch-TOGは、異なる微小管領域を認識し結合して、微小管先端の挙動に異なる作用を及ぼす。
これは、微小管が伸長する時、素繊維が閉じる前にチューブリンがランダムに付加されながら、各素繊維が異なる長さで伸長することを示唆している。100nmという長さはこれまでに予想されていたよりもずっと長く、チューブリン2量体の約12個分にあたり、従来の微小管の伸長様式の諸説に貴重な知見を与えるとした。
さらに、サンプルの表面から約200nm以内の距離にある蛍光物質だけを可視化する「全反射顕微鏡」を用いて、細胞の表面近くに位置する微小管を詳細に観察。
その結果、EB1は微小管先端を細胞表層に結合させて微小管を正しく配置させるのに対し、ch-TOGは微小管ネットワーク全体の再配置を促す効果を持つことが判明したのである。つまり、EB1とch-TOGは微小管の異なる場所に結合し、微小管に対して異なる役割を担っていたというわけだ。
これらにより、微小管の先端で厳密に住み分けされた多様な分子は、微小管を正しく配置するように機能し、細胞外からの情報の正確な伝達と細胞の適切な生理活動に寄与すると考えられるとした。
今回、超解像顕微鏡技術と新しい画像解析手法を組み合わせて25nmの分解能を達成し、微小管先端部分に新たな構造が明らかにされた。今後、解析の自動化などで多くのデータを統合すると、解析精度の向上が見込まれる。この解析手法は、細胞骨格研究だけでなく、細胞膜や核などの構造研究や細胞接着研究など、さまざまな研究分野にも適用できるという。
また医療分野では、微小管は抗がん剤の標的とされている。そのため、「タキソール」をはじめとした微小管阻害剤が抗がん治療に用いられてきた。しかし、副作用の強さや薬剤耐性細胞の出現などの問題があり、新たな抗がん剤の開発が必要だ。今後、微小管に関する知見を積み重ねることで、副作用の少ない、特定な領域を標的にした抗がん剤候補分子の選定などに貢献すると期待できるとしている。