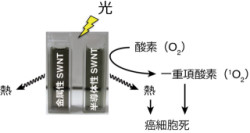
京都大学は10月19日、半導体性の「単層カーボンナノチューブ(Single-Walled carbon NanoTube:SWNT)」が、生体に優しい近赤外光の照射によって「活性酸素種」を効率よく生成し、さらにその活性酸素種ががん細胞を死滅させることを発見したと発表した。
成果は、京大 物質-細胞統合システム拠点(iCeMS=アイセムス)助教・iCeMS京都フェローの村上達也氏、iCeMSの今堀博教授を中心に、iCeMS・薬学研究科の橋田充教授、iCeMSの磯田正二客員教授、同・辻本将彦研究員らを加えた研究グループによるもの。研究の詳細な内容は、米国東部時間10月19日付けで米国化学会誌「JACS」に掲載された。
カーボンナノチューブ、カーボンナノホーン、フラーレンなどのカーボンナノ材料は、生物医学分野への応用が大いに期待されている。中でもSWNTは、生体に優しい近赤外領域の650.900nmの光を効率よく吸収できるという特性を持つ。
SWNTは吸収した光エネルギーを熱に変換する「光線温熱効果」を持っていることがわかっており、近年では、その熱を利用したがん治療法の開発に注目が集まってきている。
SWNTは単層の「グラフェンシート」がチューブ状に折り畳まれた構造をしており、その折り畳まれ方によって、金属と半導体のどちらかの性質を示す。半導体性材料は、光照射によって発光する、あるいは活性酸素種を生成する「光線力学効果」を持つ。活性酸素種は強力な抗がん活性を示すことから、光線力学療法は次世代のがん治療法として期待されている。
このような背景から、研究グループは今回、金属性と半導体性SWNTが近赤外光照射下で、どのような光応答性を示すかを調べた。
研究グループはまず、SWNTを金属性SWNTと半導体性SWNTへ分離濃縮し、それらへ近赤外レーザーを照射。すると、金属性SWNTに比べて半導体性SWNTは、やや低い光線温熱効果を示す一方、非常に高い光線力学効果を示すことを世界で初めて明らかにした。
さらに、この半導体性SWNTの光線力学効果はがん細胞を死滅させるのに十分なものであることも発見。今後、半導体性SWNTは、光線温熱効果と光線力学効果の2つのメカニズムでがん細胞を死滅させるナノ材料として活用されることが期待される。
まず、金属性SWNTと半導体性SWNTへの分離・濃縮は、タンパク質精製用のゲルが用いられた。SWNTは水にまったく分散しないため、それぞれの分散液には、SWNT研究で頻用されるSDSなどの合成界面活性剤が含まれている。
この結果、元のSWNTを、金属性対半導体性の量比が55:45と14:86のSWNTに分離することに成功した。なお、金属性SWNTが濃縮された前者をm-SWNT(metallic-SWNT)、半導体性SWNTが濃縮された後者をs-SWNT(semiconducting SWNT)と呼ぶ。
得られた各SWNT分散液に808nmの近赤外レーザーを照射すると、その光線温熱効果によって、いずれの分散液の温度も上昇したが、その温度上昇は、s-SWNTよりもm-SWNTの方が大きいことがわかった。つまり、m-SWNTはより高い光線温熱効果を示すことがわかったのである。
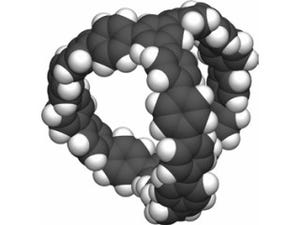
次に同じ実験条件で、活性酸素種の生成を比較した。O2からの活性酸素種の生成メカニズムは「type I」と「type II」の2種類があり、前者では「スーパーオキシドアニオン(O2●-:画像2)」、後者では「一重項酸素(1O2:画像3)」が生成される。ちなみに光線力学療法で強力な抗がん活性を示すとされているのは、1O2だ。

|

|
|
画像2。スーパーオキシドアニオンの化学式 |
画像3。一重項酸素の化学式 |
これらの活性酸素種の検出試薬存在下、808nmレーザーをそれぞれのSWNTに対して照射が行われ、いずれの活性酸素種もs-SWNTでのみ生成を確認することに成功した。すなわち、近赤外光照射下、s-SWNTはm-SWNTよりも非常に高い光線力学効果を示すことがわかったのである。それらの生成量はレーザーパワーに比例して増加した形だ。
また、s-SWNT分散液中に酸素を吹き込んでからレーザー照射すると、1O2の生成のみ増強され、このことはs-SWNTが従来の光線力学効果メカニズムにしたがって活性酸素種を発生したことを示している。
最後にs-SWNTの光線力学効果が、がん細胞を死滅させるかどうか調べられた。前述の通り、s-SWNTはまったく水に分散しないため、これまで合成界面活性剤を用いて実験が行われてきた。しかし合成界面活性剤は強い細胞毒性があるため、細胞実験を行うためにはs-SWNTを別の物質で分散安定化する必要があったのである。
研究グループでは、「高比重リポタンパク質(HDL=High-density lipoprotein)」も研究対象としており、HDLはSWNTに吸着することが知られている。試行錯誤の結果、HDLを用いてs-SWNTの分散安定性を保持しつつ、合成界面活性剤由来の細胞毒性をほぼ完全になくすことに成功した。
このHDL処理s-SWNTをがん細胞の培養液に添加し、808nmレーザーを10分間照射すると、45%のがん細胞が死滅した。重要なことに、1O2の消光剤を添加してレーザー照射すると、がん細胞の死滅率は28%に低下し、1O2がs-SWNTの殺細胞活性に寄与することが明らかとなった。この時培養液の温度は41℃にまで上昇していたことから、s-SWNTは1O2と熱の両方を用いてがん細胞を死滅させたと考えられる。
これまで、SWNTの発熱作用が、がんの光線治療メカニズムとして注目されてきたが、今回の研究では、HDL処理s-SWNTが活性酸素種の1O2を生成してがん細胞を死滅させることがはじめて明らかにされた。
次の課題として、s-SWNTとがん細胞の詳細な殺細胞メカニズムを解明することが重要だという。1O2の寿命は非常に短く、生成した場所から10nm程度しか移動できないとされている。さらに、1O2による主要な殺細胞効果はミトコンドリアダメージに由来するとの報告もあることから、s-SWNTは細胞内に存在する可能性もあるという。
今後、HDL処理s-SWNTが細胞とどのように相互作用しているのか調べると共に、iCeMSの橋田グループなどと生物医学的な実験を進める予定とした。