科学技術振興機構(JST)と筑波大学は、敗血症の発症に関与する「免疫受容体」を発見し、問題となっている「敗血症」の予防や治療につながる新しい手法の開発に成功したと発表した。
研究はJST課題達成型基礎研究の一環として行われ、成果は筑波大 医学医療系の渋谷彰教授と小田ちぐさ助教、京都大学の長田重一教授、大阪大学の菊谷仁教授らの研究グループによるもの。研究の詳細な内容は、米国東部時間7月23日付けで科学誌「Journal of Experimental Medicine」オンライン速報版に掲載された。
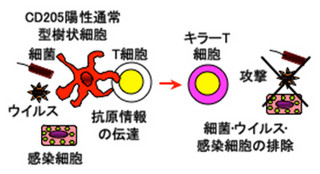
免疫受容体の働きは、免疫細胞の細胞膜に存在して外界からの刺激や情報をキャッチして細胞内に伝えることだ。病原体や異物が体内に侵入すると、多種多様な免疫細胞が互いに連携してこれらを排除するが、そのためには特定の刺激や情報をそれに対応した免疫受容体がキャッチして免疫反応を起こす必要がある。
研究グループは2003年に、肥満細胞などの細胞膜上に発現する新しい免疫受容体を世界に先駆けて発見し、これを「MAIR-I(別名CD300a)」と名付けた。しかし、この免疫受容体の生体内での働きについては、世界中の多くの研究グループによる精力的な研究にも関わらず、不明なままだった。
そこで研究グループは2011年になって、MAIR-Iがどのような情報をキャッチするのかを検討。MAIR-Iがアポトーシスで死んだ細胞の細胞膜上に発現するリン脂質「フォスファチジルセリン(PS)」と結合することを突き止めた。
その結果、MAIR-Iはアポトーシスによって生じた死細胞の出現を感知し、免疫反応をコントロールする免疫受容体であることが判明したのである(画像1)。
一方、敗血症とは、細菌による感染を発端として、細菌が産生する「エンドトキシン(LPS)」などの毒素が全身に広がり、多臓器不全、血圧低下、ショックなどの症状を引き起こす重篤な全身疾患だ。
腹膜炎や肺炎、術後感染などからの敗血症の発症数は世界的に増えつつあり、通常は感染症に対しては抗生物質などによる治療を行うが、敗血症に至ると有効な手立てがなく、高い確率で死に至ってしまう。
また、日本における同疾患の発症は年に38万人以上と推計され、米国では毎年およそ100万人の患者が発症し、その20~30%が死亡している。集中治療が必要な患者の死因としては最多の疾患で、新たな治療法の確立が待たれている。
これまで、細菌に感染すると、免疫細胞の1種である「肥満細胞」が感染局所でそれをいち早く感知し、白血球の1種の「顆粒球」を感染局所に動員して細菌を直接死滅させることで、敗血症の発症を抑制することが知られていた。
しかし、肥満細胞の働きがどのようにコントロールされているのか、また顆粒球が存在するにも関わらず、その仕組みを破綻させて敗血症が発症する理由については、十分には明らかにされていなかったのである。
研究グループは今回、肥満細胞の細胞表面膜タンパク質である免疫受容体MAIR-Iが、生体内でどのような働きをするかを解明するために、MAIR-Iを産生できない遺伝子欠損マウス(欠損マウス)を作って検討を行った。
MAIR-Iは死細胞を感知すること、MAIR-Iが発現する肥満細胞は敗血症発症に重要な働きをすることに着目し、MAIR-Iと敗血症発症との関連が調べられたのである。
腹膜炎は腹腔と腹部の臓器を覆っている腹膜に何らかの原因で細菌が感染し、死細胞が多数出現して炎症を起こす疾患で、進行すると敗血症になってしまう。野生型マウスと欠損マウスで腹膜炎による敗血症を誘導し(腹膜炎-敗血症モデル)、両者の生存期間の比較が行われた。
その結果、MAIR-Iを産生する野生型マウスでは、腹膜炎発症80時間後の生存率が約10%、100時間後にはすべて死亡したのに対し、MAIR-Iを産生しない欠損マウスでは腹膜炎発症80時間後の生存率は約60%、100時間後は約40%で、生き残ったマウスはその後回復して死亡することはなかった(画像2)。
この際、欠損マウスの感染場所である腹腔内では、野生型マウスの腹腔内より細菌を直接死滅させる顆粒球が増加しており、実際に細菌の数が減少しているのが確認されている(画像3)。
|
|
|
|
画像2。MAIR-I遺伝子欠損マウスでは敗血症による生存率が改善する。野生型、及びMAIR-I遺伝子欠損マウスに盲腸を結紮穿孔して腹膜炎を誘導し、敗血症を引き起こさせ、生存率を観察するとMAIR-I遺伝子欠損マウスでは生存率が改善した |
画像3。MAIR-I遺伝子欠損マウスでは感染局所での顆粒球の数が増加し、細菌の数が減少する。腹膜炎をきたしているマウスの腹腔中の顆粒球数、及び細菌数が測定された |
欠損マウスで敗血症発症後の生存率が高かったメカニズムを明らかにするため、野生型マウスと欠損マウスから肥満細胞を取り出し、敗血症を引き起こす原因となる毒素LPS、及びMAIR-Iと結合するPSを細胞表面に持つ死細胞と一緒に培養した。
その結果、欠損マウス由来の肥満細胞は野生型マウス由来の肥満細胞より、顆粒球を動員する働きのある「ケモカイン」(タンパク質の1種)を多量に産生していることが判明(画像4)。
さらに、MAIR-Iの働きを抑えるタンパク質「MFG-E8」を加えると、欠損マウス由来と野生型マウス由来の肥満細胞からのケモカインやサイトカインの産生量は同等になった(画像5)。このことから、肥満細胞に存在するMAIR-Iは死細胞のPSと結合し、顆粒球を動員する働きのあるケモカインの産生を抑制していることが判明したのである。
そこで研究グループは今回、肥満細胞のMAIR-Iと死細胞のPSの結合をブロックできれば、敗血症を抑えることが可能ではないかと推察。そのため、野生型マウスで腹膜炎を起こす直前と、腹膜炎発症18時間後にMAIR-Iに対する中和抗体を腹腔内に投与した。
比較実験として投与した対照抗体においても生存率が若干向上したものの、中和抗体を投与したマウスでは対照抗体を投与したマウスに比べて約35%から約80%へと増加(画像6)。同様にMAIR-Iと死細胞のPSへの結合をブロックするMFG-E8を投与すると、腹膜炎発症80時間後の生存率が約10%から約40%へと約4倍に上昇したのである(画像7)。
敗血症は手術に伴って起こるなど、その発症が予見される場合も多いことから予防法の確立は重要だ。今回の研究成果により、世界中で毎年100万人以上が死亡する敗血症の予防や治療にはMAIR-Iの働きを抑える中和抗体またはMFG-E8が有効な治療薬として期待されるという。
また、肥満細胞は抗原抗体反応の結果としてヒスタミンなどの化学物質を放出することで、アレルギー反応を引き起こす原因にもなる。アレルギー反応が起こっている部位では、多くの細胞がアポトーシス死を起こしており、MAIR-Iは過剰なアレルギー反応を抑える上で重要な役割をしている可能性も示唆されるという。その点で、MAIR-Iはアレルギーの治療や予防のターゲットにもなることが期待されると、研究グループはコメントしている。