九州大学と科学技術振興機構(JST)は、JST課題達成型基礎研究の一環として、タンパク質「DOCK2(ドック2)」の機能を阻害する化合物を同定し、これを用いて、白血球の炎症反応をブロックできることを実証したと発表した。成果は、九州大学生体防御医学研究所の福井宣規主幹教授、同錦見昭彦助教、東京大学大学院薬学系研究科の金井求教授、長野哲雄教授らの共同研究グループによるもの。研究の詳細な内容は、4月20日付けで米科学雑誌「Chemistry&Biology」に掲載された。
免疫システムは、病原微生物やがん細胞といった異物を認識して除去するシステムであり、これら異物から身体を守る上で必須の防御機構だ。しかし、本来身体を守るはずの免疫システムが、自分自身の細胞や組織を誤って攻撃することによって引き起こされる自己免疫疾患が問題になっている。
また、近年盛んに行われるようになった臓器移植においても、移植された臓器を免疫システムが異物として攻撃する移植片拒絶が、臓器移植の成功を阻んでいるのは知られた事実だ。こういった過剰な免疫応答に起因する疾患に、どう対応すべきかは現代医学が直面している課題であり、このため炎症応答を効果的に抑制する薬剤の開発が望まれている。
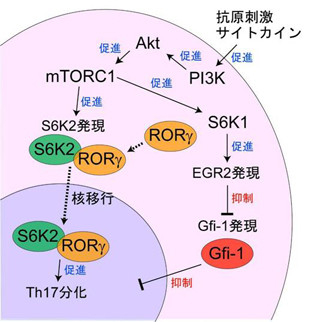
福井主幹教授はこれまで、DOCK2が免疫細胞に特異的に発現し、免疫応答を制御するカギとなるタンパク質であることを世界に先駆けて明らかにしてきた(画像1)。DOCK2は、Racというタンパク質を活性化させ、アクチンの重合を誘導することで、白血球の運動や活性化を制御する。
Racは「グアニンヌクレオチド結合タンパク質」で、細胞の運動などに関わる細胞内のシグナル伝達を調節する役割を担う。「グアノシン二リン酸(GDP)」を結合している時が不活性型で、「グアノシン三リン酸(GTP)」が結合すると活性型となり、下流にシグナルを伝えるスイッチとして細胞内のシグナル伝達を調節している。
また、アクチンは真核細胞に最も多量に含まれるタンパク質で、細胞骨格を作るタンパク質の1つだ。アクチン同士が重合、または脱重合することにより、細胞の形態や運動が制御される仕組みである。
画像1は、免疫細胞におけるDOCK2の役割を示した模式図だ。DOCK2は、各種受容体(抗原受容体、「ケモカイン受容体」、「Toll(トル)様受容体」など)を介して受け取った細胞外の情報をRacの活性化に変換し、リンパ球の運動や活性化、サイトカイン産生といったさまざまな免疫機能を制御している。
なお、ケモカインとは「CCL21」、「CXCL13」、「インターロイキン8」など、特定の細胞や炎症組織から分泌され、リンパ球などの免疫細胞を誘引する働きを持つタンパク質の総称だ。血管から脾臓やリンパ節、あるいは炎症部位への免疫細胞の遊走を促す。免疫細胞の種類によって発現しているケモカイン受容体が異なるため、各々のケモカインが特定の細胞を特定の部位に誘導することができる。
また、Toll様受容体とは、細胞表面にある受容体タンパク質で、自然免疫に関わる機能を持つ。
なお、自己免疫疾患や移植片拒絶は、リンパ球といった白血球が標的臓器に浸潤し、活性化されることで引き起こされる病態だ。そのため、DOCK2はこれら免疫難病をコントロールするための分子標的となる可能性がある。
実際、DOCK2欠損マウスに心臓移植すると、免疫抑制剤を使用しなくても心臓が長期にわたり働き続けることが可能となるし、DOCK2を欠損させることで、自己免疫疾患モデルマウスにおける疾患発症が完全にブロックされることが実証済みだ。
そこで研究グループは、新しいアプローチによる免疫難病の治療薬、予防薬の開発を目指して、DOCK2によるRac活性化を効果的にブロックできる低分子化合物の探索をスタートさせた。
DOCK2は、DOCKファミリータンパク質に特有の「DHR-2ドメイン(構造)」を持ち、このドメインを介して、Racに結合しているGDPをGTPに変換することで、Racを活性化する(画像2)。
画像2は、DOCK2を介したRac活性化の概略図だ。RacはGDPと結合している時は不活性型であるが、GTPと結合すると活性型となり、下流にシグナルを伝達する。活性型と不活性型を行き来する様子を、スイッチのONとOFFの切り替えになぞらえて「分子スイッチ」と呼ぶこともある。
DOCK2は、DHR-2ドメインがRacに直接結合することにより、不活性型のRacからGDPを引き離してGTPを結合させる作用、つまりRacをOFFからONに切り替える役割を担う。
研究グループは、東大創薬オープンイノベーションセンターが保有する「化合物ライブラリー」の中から、DOCK2のDHR-2ドメインとRacの相互作用を阻害するものを探索した。同センターは文部科学省委託事業「ターゲットタンパク研究プログラム」の一環として、日本初の大規模な公的化合物ライブラリーを整備し、大学や研究機関などに向けて化合物の提供を行っている施設だ。
このようにして、化合物を約130個に絞り込んだ後、DHR-2ドメインによるRac活性化を阻害すること、リンパ球の運動を抑制すること、細胞に対して毒性を示さないことを指標にスクリーニングを続けた結果、最終的に有望な化合物を1つ同定し、「CPYPP」と命名されたのである。
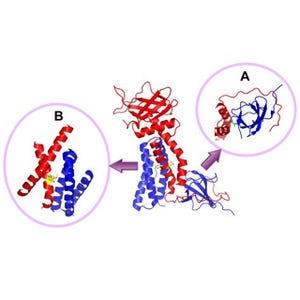
詳細な解析の結果、CPYPPは、DOCK2のDHR-2ドメインに直接作用することにより、Racの活性化することを抑制することが明らかとなった(画像3・4)。CPYPPを培養液中に加えておくと、効率よく細胞に取り込まれ、DOCK2によるRac活性化を抑制する。

|

|
|
画像3(左)はCPYPPがDOCK2のDHR-2ドメインを介したRacの活性化を阻害する模式図で、画像4がグラフ。GDP結合型Rac(不活性型)がGTP結合Rac(活性型)になると蛍光強度が上昇するアッセイ系を用いてCPYPPの効果を検討した。GDP結合型RacにDOCK2 DHR-2ドメインを加えることによって見られる蛍光強度の上昇(赤)が、CPYPPの添加により濃度依存的に抑制された |
|
一方、DOCK2以外にも、「Trio」や「Tiam1」といったタンパク質がRacを活性化することが知られているが、CPYPPはこれらほかの因子を介したRac活性化には影響を与えなかった。このことから、CPYPPはDOCK2を介したRac活性化を選択的に阻害することが明らかになったのである。
リンパ球にCPYPPを作用させると、「ケモカイン」や抗原の刺激によって誘導されるRacの活性化がブロックされ、その結果リンパ球の運動や増殖が顕著に抑制された(画像5~8)。

|

|
|
画像5・6。CPYPPがリンパ球の運動や活性化をブロックできることの模式図その1。CPYPPは、ケモカインによって誘導されるリンパ球の運動を、濃度依存的にブロックする。なお、グラフ中のNCとは、ケモカイン非存在下での「遊走率」のこと |
|

|

|
|
画像7・8。CPYPPがリンパ球の運動や活性化をブロックできることの模式図その2。CPYPPは、混合リンパ球反応(C57BL/6マウス由来のT細胞のB10.BRマウス脾細胞に対する反応)におけるT細胞の増殖応答を、濃度依存的にブロックする |
|
特殊な白血球の「形質細胞様樹状細胞」が、ウイルス感染に伴って大量に産生するI型インターフェロンは、全身性エリテマトーデスや乾癬といった自己免疫疾患の発症に深く関わることが示唆されている。形質細胞様樹状細胞にCPYPPを作用させると、DOCK2を欠損した場合と同様に、I型インターフェロンの産生が選択的に抑制された(画像9・10)。

|

|
|
画像9(左)・10。CPYPPが。形質細胞様樹状細胞によるI型インターフェロン産生をブロックする際の模式図。CPYPPは、TLR9(Toll様受容体の1種)の刺激によって誘導されるI型インターフェロンの産生を、濃度依存的にブロックできるが、別のサイトカイン(インターロイキン12)の産生には影響を与えない |
|
以上より、DOCK2によるRacの活性化を抑制する化合物を同定し、DOCK2を介した炎症応答が、化合物を使ってブロックできることを初めて実証した。
CPYPPは、DOCK2の機能をブロックできる初めての化合物だ。今後CPYPPの構造をベースに最適化を進めることで、より効果的かつ安全にDOCK2の機能を抑制する化合物が創出でき、免疫難病に対する新しい治療薬や、拒絶反応の抑制に用いられる「予防薬(免疫抑制剤)」の開発につながることが期待できるとしている。