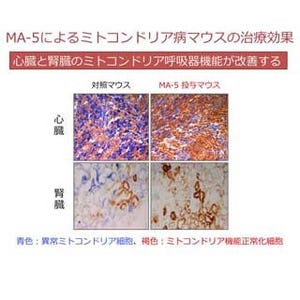
東北大学は、新たなATP産生活性化のメカニズムを解明し、ATP産生メカニズムを活性化する薬剤MA-5が、ミトコンドリア病の患者由来細胞や病態モデルマウスにおいて病態を改善する効果があることを明らかにしたと発表した。
|
|
|
ATP合成の新たなメカニズム。MA-5はミトコンドリア内のミトフィリンと結合しATP合成酵素複合体の形成を促進することでATP産生を活性化する。(出所:東北大学プレスリリース) |
MA-5は多くの疾患の治療薬となる可能性がある(出所:東北大学プレスリリース) |
同研究は、東北大学大学院医学系研究科および大学院医工学研究科の阿部高明教授、松橋徹郎研究員、自治医科大学小児科の小坂仁教授、筑波大学の中田和人教授、岡山理科大学の林謙一郎教授らの研究グループによるもので、同研究成果は、Cell誌とLancet誌が共同でサポートする新規オープンアクセス誌EBioMedicine誌に2017年5月に掲載された。
ミトコンドリアは細胞内のエネルギー産生工場というべき細胞小器官であり、生命活動維持に必要なエネルギー(ATP)の95%を産生している。ミトコンドリアの機能が異常となるとATPの産生が低下し、結果として全身性の臓器障害、いわゆるミトコンドリア病を引き起こすことが明らかにされている。ミトコンドリア病は、その発症時期や障害臓器などの臨床症状は様々であり、特異的な診断マーカーも確立されていないため、診断が非常に困難な病気となっている。実際の患者数は不明だが、発症頻度は約5,000人に1人との報告もあるという。
これまでに東北大学の阿部教授のグループは、慢性腎臓病による尿毒症患者の血中の腎不全物質を解析する過程で、ある種のインドール化合物にATPや造血因子の産生を亢進する作用があることを見いだしていた。2015年、阿部教授のグループは、そのインドール化合物を元に人工的に合成した新規化合物Mitochonic acid 5(MA-5)が、ミトコンドリア病患者の皮膚から培養した細胞の生存率を上昇させることを報告し、さらに2016年、MA-5をミトコンドリア機能異常症マウスに投与すると、心臓や腎臓の機能異常が改善し、マウスの生存率が上昇することを明らかにした。しかし、MA-5がミトコンドリアにおいてATP産生を活性化するメカニズムについては不明のままとなっていた。
今回、同研究グループは、MA-5がミトコンドリアの内部構造(クリステ)を維持するために重要なタンパク質であるミトフィリンに結合し、ATPを合成する酵素の複合体の形成を促進することでATP産生の効率を高めているという新しいATP合成のメカニズムを明らかにした。また、様々なミトコンドリア病患者の皮膚から培養した細胞(線維芽細胞)を用いて、MA-5の細胞保護効果を調べた結果、25症例中24症例という高い割合でその細胞保護効果が認められた。
ミトコンドリア機能異常は、ミトコンドリア病だけでなく神経変性疾患や心臓病、腎臓病、糖尿病等の疾患の原因となることが明らかとなっており、MA-5はミトコンドリア病だけでなくこれらの疾患の治療にも大きく貢献する画期的な薬剤となる可能性があるという。MA-5は既に国内外の特許申請を完了している化合物であり、現在、AMED難治性疾患実用化研究事業の支援を受け、2018年にヒトへの投与に向け安全性の確認を行なっている段階だということだ。