東京大学(東大)は7月22日、脳内マリファナの一種「2-アラキドノイルグリセロール(2-AG)」がてんかんを抑制するメカニズムを明らかにしたと発表した。
同成果は、東京大学大学院医学系研究科 機能生物学専攻 神経生理学分野 狩野方伸教授、菅谷佑樹助教らの研究グループによるもので、7月21日付の米国科学誌「Cell Reports」オンライン版に掲載された。
マリファナに含まれる精神作用物質「カンナビノイド」は、脳内のカンナビノイド受容体と呼ばれるタンパク質に作用することでその効果を発現するが、もともと脳内にはカンナビノイド受容体の活性化を引き起こす「内因性カンナビノイド」が存在している。
主な内因性カンナビノイドには、2-AGとアナンダマイドの2種類があるが、これらがカンナビノイドCB1受容体を介して、てんかんの症状であるけいれん発作を抑制している可能性が動物モデルにおいてこれまでに報告されていた。しかし、2-AGとアナンダマイドのうちどちらが重要なのか、またどのようなメカニズムで発作を抑制しているのかは明らかになっていなかった。
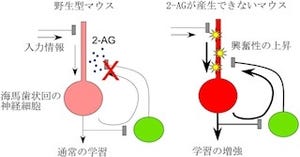
今回、同研究グループは、2-AGがけいれん発作に与える影響を明らかにするために、2-AGの産生酵素であるDGLαが欠損したマウス(DGLαノックアウトマウス)、CB1受容体が欠損したマウス(CB1ノックアウトマウス)を用いて実験を実施。DGLαノックアウトマウスでは、CB1ノックアウトマウスよりもけいれん発作が起きやすくなっており、けいれん発作による死亡率も上昇した。
この結果から、2-AGはCB1受容体以外にも働いてけいれん発作を抑制していることが考えられたため、2-AGの作用する受容体として知られているCB2受容体の機能を阻害する薬をCB1ノックアウトマウスに投与し、その後にけいれん発作を誘発。その結果、DGLαノックアウトマウスと同等の重篤な発作が認められた。したがって、2-AGがCB1受容体とCB2受容体を介して、けいれん発作を抑制していることが示唆されたといえる。
また、自発的にけいれん発作が繰り返し出現するモデルマウスを用いて、2-AGの働きを強くする実験を行ったところ、てんかん患者でみられるような自発的に繰り返されるけいれん発作を抑制できる可能性が示された。
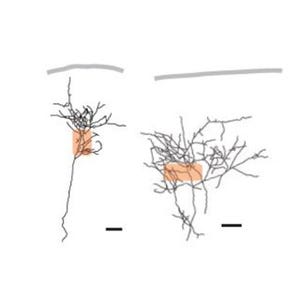
さらに、DGLαノックアウトマウスでは野生型マウスと比べ、てんかんを発症する異常な神経回路が早く形成され、逆に2-AGの量を増やすと同回路の形成が遅くなったことから、2-AGはけいれん発作を抑制するだけでなく、てんかんの発症も阻止しているということも明らかになっている。
同研究グループは、今後モデル動物やヒトでの研究が進むことで、新しい抗てんかん薬の開発につながることが期待されるとしている。