東北大学は3月6日、これまで不可能だった、メラニン色素を合成・貯蔵する小胞「メラノソーム」上に人為的なタンパク質分子を送り届けることができる技術の開発に成功したと発表した。
成果は、東北大大学院 生命科学研究科 修士大学院生の石田森衛氏、同・荒井沙希氏、同・福田光則教授らの研究チームによるもの。研究の詳細な内容は、2月28日付けで米科学誌「Journal of Biological Chemistry」電子版に掲載された。
ヒトの肌や髪の毛に含まれる黒いメラニン色素は、有害な紫外線から体を守るために重要な役割を担う。しかし、その一方でメラニン色素は蓄積してしまうとしみやそばかすの原因になるし、逆に部分的な脱落してしまうと「白斑」の原因になってしまう。
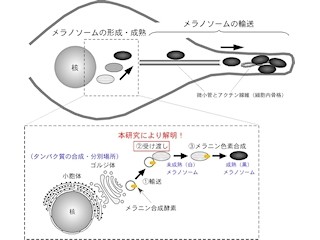
メラニン色素は、「メラノサイト(メラニン色素産生細胞)」に存在する「メラノソーム」と呼ばれる袋(小胞)の中で合成・貯蔵されている。そしてメラノソームは成熟すると、メラノサイトの細胞内を細胞骨格に沿って輸送され、肌や髪の毛を作る細胞に受け渡されて初めて肌や髪の毛の暗色化が起こる仕組みだ。
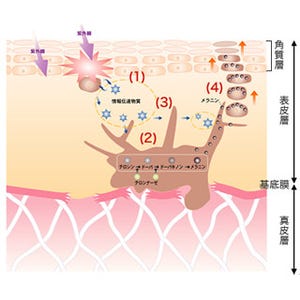
画像1は、そうした特定の細胞小器官(オルガネラ)へのタンパク質分子の輸送も描かれた、メラノサイトの内側を表した模式図だ。メラノサイトに限らずすべての真核細胞の細胞内は、膜で包まれたさまざまな細胞小器官(袋)で満たされているが、この図では簡略化されており、核、小胞体、ミトコンドリア、メラノソームのみが示されている。
それぞれの細胞小器官は独自の役割を担っており、その機能を果たすために独自のタンパク質分子を持っており、メラノソームもメラニン合成酵素などの特殊なタンパク質分子を多数含む。これらのタンパク質分子にはそれぞれが働くべき細胞小器官にのみ輸送される必要があるため、それぞれの分子に輸送シグナル(配列)が備わっていると考えられている。
それを表したのが画像1左下の拡大図で、これまでの研究により、核、ミトコンドリア、小胞体などへの輸送シグナルが同定されており、任意のタンパク質分子を特定の細胞小器官に輸送する技術も開発済みだ。しかしこれまで、メラノソームにタンパク質分子を輸送するツールは開発されていなかった。
そこで研究チームは今回、まずメラノソームに局在することが知られているタンパク質の中で、メラノソーム上の荷札として機能する形で、その輸送(細胞辺縁部から中心方向へと微小管を伝って行う「逆行輸送」)に関わる「メラノレギュリン(Mreg)」分子に着目。まず、この分子のメラノソームへの局在化に必要なアミノ末端側の領域を決定し、これらの領域を用いて「メラノソームターゲティングタグ(MST tag:melanosome-targeting tag)」が新規に開発された(画像2~4)。
次に、得られたMSTタグを本来メラノソームに局在しないタンパク質分子に融合させ、得られた融合タンパク質のメラノソームへの局在化やメラノソームの分布に対する影響が検討されたのである(画像5~11)。その結果、以下のことが明らかにされた。
まず1つ目は、Mreg分子のアミノ末端領域(アミノ酸番号1~139:画像2)はメラノソームへの局在化に必要不可欠な領域であるということ。Mreg分子はメラノソームの「微小管逆行性輸送」(画像1)に関与し、Mreg分子はアミノ末端側でメラノソームに局在し、カルボシキル末端側で「RILP」や「ダイニン・ダイナクチン複合体」と結合する。なお、アミノ末端領域のみを発現してもメラノソームの形成や分布には影響を与えないという(画像3・4)。
また今回はMSTを融合させたタンパク質を可視化するため、カルボシキル末端側には「赤色蛍光タンパク質(mStr)」が融合されている。例えば、画像5の「Rab5A」や画像6~7の「Rab27A(Q78L)」など、任意のタンパク質をMSTとmStrの間に挟んでメラノサイトに発現させると、メラノソーム上に局在する仕組みである。
画像3は、MSTタグのメラノソーム局在化の顕微鏡写真だ。mStrのみをメラノサイトに発現させても、メラノソーム上には局在しないが(上段)、Mreg分子とmStrを融合させた「Mreg-mStr」はメラノソーム上に局在し、微小管逆行性輸送を促進することによりメラノソームの核周辺での凝集を引き起こす(中段)。
一方、MSTタグのみを融合させたMST-mStrはメラノソーム上に局在してもメラノソームの凝集を誘導しない。挿入図は四角の部分の拡大図を示し、右列の重ね合わせの図ではメラノソームが緑色の疑似カラーで示されている。点線はメラノソームの凝集を起こした細胞の縁の部分を示したものだ。
そして画像4が、Mreg-mStrおよびMST-mStrを発現するメラノサイトにおけるメラノソームの凝集率を示したグラフ。Mreg-mStrを発現する細胞では頻繁にメラノソームの核周辺での凝集が観察されたが、MST-mStrではメラノソームの分布にはまったく影響が認められなかったという。

|

|

|
|
画像2(左):Mreg分子および今回開発されたMSTタグの模式図。画像3(中):MSTタグのメラノソーム局在化。スケールバー=20μm。画像4(右):Mreg-mStrおよびMST-mStrを発現するメラノサイトにおけるメラノソームの凝集率を示したグラフ。**, p<0.01, Student's unpaired t test. |
||
2つ目は、MSTを融合したタンパク質分子がメラノソームに局在化することを確認したこと。例えば、別の細胞内小器官「初期エンドソーム」に局在するRab5Aという分子にMSTタグを融合すると、MST-Rab5Aはメラノソーム上に局在するという具合だ(画像5)。
画像5は、MSTタグを融合したRab5Aのメラノソームへの局在化をとらえた顕微鏡画像。Rab5Aは初期エンドソームに局在する分子だが(中段)、この分子の脂質化修飾部位を外しMSTタグを画像2のように融合させると、メラノソーム上に局在化することが可能だ(下段)。
挿入図は四角の部分の拡大図で、右列の重ね合わせの図ではメラノソームが緑色の疑似カラーで示されている。初期エンドソームとメラノソームは別個の細胞小器官のため、Rab5A(赤)とメラノソーム(緑)のシグナルはまったく重ならない(中段)。一方、MST-Rab5A(赤)はメラノソーム(緑)上に局在するのが確認可能だ。
3つ目は、「Q78L」のアミノ酸変異を持つ低分子量Gタンパク質「Rab27A」分子はメラノソームに局在化することができず、メラノソームの輸送障害を引き起こす(色素異常の症状を示す「グリセリ症候群」の特徴)。この変異体Rab27AにMSTタグを融合させるとメラノソームに局在し、メラノソーム輸送が回復するのである(画像6・7)。
なおRab27Aは、メラノソームの「アクチン線維」上の輸送を行う際(画像1)の、メラノソーム上の荷札として機能するタンパク質だ。「GTP(グアノシン三リン酸)」を結合した活性化型のRab27A分子はメラノソーム上に局在し、ここに運転手役の「Slac2-a」(「メラノフィリン」ともいう)と運送トラック役の「ミオシンVa」が結合することにより、アクチン線維に沿った細胞膜直下までのメラノソーム輸送を促進する画像(画像8・9)。
Rab27Aの機能が損なわれているグリセリ症候群患者のメラノサイトでは、メラノソームがアクチン線維に上手く受け渡されず、微小管逆行性輸送によりメラノソームが核周辺へと押し戻され、メラノソーム凝集の症状を示してしまう。今回の研究で用いられたRab27A(Q78L)変異体は78番目の「グルタミン」が「ロイシン」に置換されており、GTPアーゼの活性がないことが知られている。
画像6は、MSTタグを融合したRab27A(Q78L)のメラノソームへの局在化とメラノソーム分布の回復を示した顕微鏡画像。RNA干渉法によりRab27Aを欠損させた細胞では、メラノソームのアクチン輸送が起こらず、メラノソームが核周辺で凝集する(最上段)。siRNAに抵抗性(SR:siRNA-resistant)のRab27AをRab27A欠損細胞に戻すとメラノソーム上に局在し、メラノソームの分布が回復する(2段目)。
Q78Lの変異を持つRab27A分子はメラノソームに局在できないため、メラノソームの分布は回復しない(3段目)。一方、MSTを融合させたRab27A(Q78L)はメラノソーム上に局在し、メラノソームの分布も回復するが(5段目)、MSTタグのみでは回復効果は認められない(4段目)。挿入図および点線は画像3の説明と同じだ。なお画像7は、画像6に示されているメラノサイトにおけるメラノソームの凝集率を示したグラフだ。

|

|
|
画像6(左):MSTタグを融合したRab27A(Q78L)のメラノソームへの局在化とメラノソーム分布の回復を示した顕微鏡画像。スケールバー=20μm。画像7(右):画像6に示されているメラノサイトにおけるメラノソームの凝集率を示したグラフ。**, p <0.01, Student's unpaired t test. |
|

|

|
|
Rab27A-Slac2-a-ミオシンVa複合体によるメラノソームのアクチン輸送の模式図(画像8(左))と、それをトラックに例えた図(画像9(右))。メラノソームを積み荷、Rab27Aを荷札、Slac2-aを運転手、ミオシンVaを運送トラック、アクチン線維を道路に例えて、それぞれの分子の機能が示されている。 |
|
4つ目は、Rab27Aはメラノソーム上の荷札役として機能し、運転手役Slac2-aおよび運送トラック役のミオシンVaをメラノソーム上に呼び込んで輸送を促進することは前述した通りだが、Slac2-a分子の「SHD(Slp homology domain)領域」を欠損させると荷札であるRab27Aを認識できなくなり、メラノソーム上には局在できなくなる(画像10)。よって、Rab27Aを欠損するメラノサイトでは、荷札がないためSlac2-a、ミオシンVaがメラノソームにアクセスできず、メラノソームの輸送障害を引き起こしてしまうのである。
ただしRab27Aに結合できない「Slac2-aΔSHD」にMSTタグを付加した「MST-Slac2-aΔSHD」をRab27A欠損細胞に発現すると、MST-Slac2-a分子はメラノソーム上に局在するため、ミオシンVaによってメラノソームの輸送が回復する仕組みだ(画像11)。
画像10は、Slac2-a分子およびMSTタグを融合したSlac2-aΔSHD変異体の模式図。Slac2-a分子はアミノ末端側にメラノソーム上のRab27A(荷札役)を結合するSHD領域を、中央部分にモータタンパク質であるミオシンVa(運送トラック役)を結合するMBD(myosin Va binding domain)領域を持つ。MST-Slac2-aΔSHDはRab27Aを認識するSHD領域を除き、代わりにMSTを融合したものである。画像5では融合タンパク質分子の検出のため、mStrの代わりにFLAGタグを使用している。
画像11は、メラノソーム凝集を示すRab27A欠損細胞におけるMST-Slac2-aΔSHDの発現を撮影した顕微鏡画像。RNA干渉法によりRab27A(最上段)を欠損させられた細胞では、メラノソームが核周辺で凝集してしまう(上段)。この細胞にSlac2-aやSlac2-aΔSHDを発現させても、荷札役のRab27Aがないため、メラノソームを認識できず、メラノソームの分布は回復しない(中央2および3段目)。
しかし、MST-Slac2-aΔSHDは荷札のRab27Aに関係なくメラノソームに局在化でき、ミオシンVaとも結合できるため、メラノソームの分布が回復する(下段)。挿入図は四角の部分の拡大図を示し、右列の重ね合わせの図ではメラノソームが赤色の疑似カラーで示されている。点線はメラノソームの凝集を起こした細胞の縁の部分を示したものだ。

|

|
|
画像10(左):Slac2-a分子およびMSTタグを融合したSlac2-aΔSHD変異体の模式図。画像11(右):メラノソーム凝集を示すRab27A欠損細胞におけるMST-Slac2-aΔSHDの発現を撮影した顕微鏡画像。Rスケールバー=20μm |
|
以上の結果から、MSTタグは成熟メラノソーム上に人為的にタンパク質分子を局在化させる初めてのツールとして利用できることが明らかになったというわけだ。また、MSTタグを融合させても、融合させた分子の機能を損なうことはなかったことから(例えば、Slac2-a分子のミオシンVa結合能など:画像10・11)、タンパク質分子の機能を保持したままメラノソーム上に局在化させることが可能となったのである。
今回の成果により、MSTタグを用いて成熟メラノソーム上にタンパク質分子を送り届ける新技術が確立された形だ。2013年度のノーベル生理学・医学賞の対象となった小胞(膜)輸送の研究分野では、特定の膜でできた細胞小器官への輸送シグナルが解明されたことにより、その細胞小器官の機能解明が飛躍的に向上してきた。今回のMSTタグの開発により、メラノソーム上に任意のタンパク質分子、あるいはその断片を局在化させることが可能となり、メラノソームの形成や輸送の詳細な分子機構の解明、ひいてはそれらの人為的な制御に応用されることが期待されるとしている。