理化学研究所(理研)は2月17日、光合成を行う微生物「ラン藻」の遺伝子を改変し、バイオプラスチックの1種「ポリヒドロキシ酪酸(PHB)」の生産量を通常のラン藻に比べて約3倍増加させることに成功したと発表した。
成果は、理研 環境資源科学研究センター 代謝システム研究チームの小山内崇客員研究員(JSTさきがけ専任研究者)、同・平井優美チームリーダー、同・酵素研究チームの沼田圭司チームリーダー、同・統合メタボロミクス研究チームの斉藤和季グループディレクター、同・及川彰客員研究員(山形大准教授)らの研究チームによるもの。研究の詳細な内容は、2月12日付けで米科学誌「Plant Physiology」に掲載された。
プラスチックは、化石燃料から生産されることや、環境中で分解されないなど、環境負荷が大きく、資源の持続的な活用の面でも問題があると指摘されているのは多くの人が知るところだろう。一方、バイオプラスチックは、生物由来で合成されるバイオマスプラスチックと、環境中で分解される生分解性プラスチックのいずれかの特性を持っている。
代表的なバイオプラスチックの1つである「ポリヒドロキシアルカン酸(PHA)」は微生物が作るポリエステルの1種で、両方の特性を併せ持つ材料だ。側鎖の組成によってさまざまな性質を持たせられる点も特徴である。しかし、現状では糖や油脂を原料としているため価格変動の影響を受けやすく、生産コストが化石由来のプラスチックに比べて高く、また強度・耐久性が低いなどの問題があるため、広範な利用には至っていない。
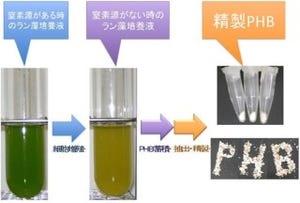
光合成を行う微生物「ラン藻」は、窒素やリンの欠乏時に、光と二酸化炭素だけで炭素およびエネルギーの貯蔵源としてPHAの1種で、3-ヒドロキシ酪酸のポリマー(ポリエステル)であるPHBを合成する(画像1)。つまり、ラン藻を用いた効率的なPHBの生産方法を確立できれば、二酸化炭素を原料とした安定的なプラスチック供給が可能となることから、環境問題を解決できるとして期待されているところだ。
ラン藻がどのようにPHBを作るのかというと、通常、培養液は緑色をしているが(画像1左)、窒素が枯渇すると、集光装置である「フィコビリソーム」を分解して黄色になり(画像1中央)、この時に合成される。窒素源が枯渇したラン藻を回収して凍結乾燥した後、有機溶媒などを用いてPHBを抽出、精製したのが画像1の右である。
そこで研究チームは今回、多数のラン藻の中でも広く研究されている「Synechocystis sp. PCC6803(シネコシスティス)」に着目し、PHBの増産を目指すことにしたというわけだ。シネコシスティスは淡水性のラン藻で、単細胞性の球菌で、直径が約1.5~2.5μm。窒素固定を行わないのが特徴の1つである。
シネコシスティスは最初に全ゲノム配列が決定されたことなどから、モデルラン藻として広く研究されており、相同組換えによる遺伝子改変が可能な上、ほかの藻類に比べて増殖が速いなど、多くの利点を持つ。
また研究チームのこれまでの研究から、PHBの合成酵素遺伝子の転写を活性化する因子としてタンパク質「Rre37」が示唆されていた。Rre37は、環境変動に合わせ細胞を適切に変化させる「レスポンスレギュレーター」であり、窒素欠乏時にその量が増えることが知られている。なおレスポンスレギュレーターとは、外部の環境変動を感知して、細胞を適切に変化させる役割を持つタンパク質のことだ。多くの場合、転写因子としてDNAに結合し、遺伝子の転写を制御する仕組みを持つ。
そこで研究チームはシネコシスティスの遺伝子を改変し、Rre37過剰発現株(Rre37の量が増加したシネコシスティス)を作製して、窒素欠乏後のPHB生産量を調べることにした。その結果、対照株(通常のシネコシスティス)に比べてPHB生産量が約2倍増加したのである(画像2)。
次に、研究チームが以前発見したPHBの合成を促進する働きを持つタンパク質「SigE」とRre37の二重過剰発現株(SigE とRre37の量が同時に増加したシネコシスティス)が作製され、そのPHB生産量が調べられた。なお、SigEはシネコシスティスが有する9つの「RNAポリメラーゼシグマ因子」の内の1つである。シグマ因子とは、RNAポリメラーゼ内でDNAに結合し、遺伝子の転写を開始する働きを持つタンパク質のことだ。研究チームによって、SigEが糖代謝の制御因子であることに加え、PHBの合成を促進することも発見されている。
そして生産量の調査の結果、対照株に比べてPHB生産量が約3倍増加することが判明。画像2が、窒素欠乏条件で培養したラン藻から抽出したPHB生産量を比較したグラフだ。Rre37過剰発現株では、対照株(野生株)の約2倍、Rre37とSigEの二重過剰発現株では約3倍に増加しているのがわかる。
Rre37過剰発現によるPHB生産量の増加の原因も調べられ、その結果、Rre37はPHBの合成だけでなく、細胞内の代謝を全体的に制御していることも確認された(画像3)。PHBは、「アセチルCoA」という物質から3段階で合成される仕組みだ。アセチルCoAは、炭素の貯蔵源である「グリコーゲン」から解糖系を経て供給される。
今回の研究により、Rre37はPHBの合成酵素遺伝子の転写を活性化すると共に、グリコーゲンの分解や解糖系の酵素の遺伝子発現を増加させることが明らかになった。生化学的解析により、分解酵素を作る「グリコーゲンホスホリラーゼ(GlgP)」遺伝子のプロモータ(遺伝子を発現させる機能を持つ塩基配列)領域に、Rre37が直接結合することがわかったのである。
また、マイクロアレイを用いた「トランスクリプトーム解析」(細胞内の転写産物量(mRNA量)を網羅的に測定する解析)が行われたところ、Rre37が、PHB合成酵素やグリコーゲン分解酵素以外の酵素も制御していることも確かめられた。得られた結果を考察したところ、炭素の代謝で有名な「クエン酸回路」と「オルニチン回路」が混ざった回路の存在が示唆されたのである(画像3)。この回路が窒素欠乏時に働くと、2分子のアンモニアが窒素源として効率的に取り込まれることから、窒素欠乏時のラン藻は、Rre37を用いてこの「ハイブリッド型の回路」を促進する可能性が示唆された。
なおクエン酸回路は「トリカルボン酸回路」、「TCA回路」、「クレブス回路」とも呼ばれる。アセチルCoAと「オキサロ酢酸」からクエン酸を合成する反応から始まる一連の代謝経路で、呼吸に用いられる還元力を生産すると共に、二酸化炭素を生成する仕組みだ。
そしてオルニチン回路は、「尿素回路」とも呼ばれる。オルニチンは、グルタミン酸から2段階の反応で合成される。通常のオルニチン回路では、オルニチンから「シトルリン」、「アルギノコハク酸」を経て、「フマル酸」と「アルギニン」が合成され、アルギニンが尿素とオルニチンになり、尿素は排出され、オルニチンが代謝回路に戻る。ラン藻などの細菌では、酵素がそろっておらず、オルニチン回路が「回路」として完成していないことも多い。
画像3はRre37によって制御される遺伝子の代謝地図。トランスクリプトーム解析より明らかになったRre37の制御下にある遺伝子を、代謝地図上に記載したものだ。PHB合成だけでなく、グリコーゲン代謝、解糖系の遺伝子を制御している。また、クエン酸回路とオルニチン回路の遺伝子も制御していることがわかっている。「メタボローム解析」の結果と合わせると、ラン藻は窒素欠乏時に、クエン酸回路とオルニチン回路のハイブリッド回路という新しい代謝回路を活性化する可能性が示唆されたというわけだ。
今回の成果により、Rre37を使った新しいPHB増産方法が発見された形だ。今後は実用化に向けて、さらなる生産量の増加を目指した研究が必要だとしている。実用化に向けては、低コストでのラン藻培養法や回収法、効率的なPHBの抽出・精製法の開発などが求められるという。
また今回の成果により、新しい代謝回路の存在が示唆された。新しい代謝回路の発見は学術的重要性のみならず、さらなる物質の増産を目指す代謝工学の面からも大きな意味があるという。今回の研究では、Rre37という制御因子を解析することにより、ラン藻のバイオプラスチック増産という応用研究と、代謝メカニズムの解明という基礎研究を同時に進めることが可能であることが示された形である。