理化学研究所(理研)と科学技術振興機構(JST)は1月20日、葉緑体の内部を生きたまま観察できる技術を開発し、コケ植物の葉緑体内で起きる「膜ダイナミクス」の可視化に成功したと共同で発表した。
成果は、理研 光量子工学研究領域 ライブセル分子イメージング研究チームの岩井優和客員研究員(科学技術振興機構(JST)戦略的創造研究推進事業さきがけ研究者)、中野明彦チームリーダーらの研究チームによるもの。研究はJST戦略的創造研究推進事業 個人型研究(さきがけ)研究領域「二酸化炭素資源化を目指した植物の物質生産力強化と生産物活用のための基盤技術の創出」の研究課題名「ライブセルイメージングによる光環境適応機構の実態解明」の一環として行われ、詳細な内容は日本時間1月20日付けで英オンライン総合学術誌「Scientific Reports」に掲載された。
植物などの光合成生物は、約30億年という長い年月の間、地球規模で起こるさまざまな環境変化に耐え抜き、適応してきた。その結果、今ではありとあらゆる自然環境下において生存、繁栄しているのは誰もがご存じのことだろう。コンクリートとコンクリートのすき間のわずかに土が除く部分にすら雑草は生えてくるし、寒暖問わずさまざまな地域に多種多様な植物が生えている。
これまでの研究から、光合成反応を調節している「光化学系タンパク質」と、太陽からの光エネルギーを集める「集光アンテナタンパク質」が「チラコイド膜」に存在し、膜内でその配置や互いの結合を変えることで、植物が光環境変化に適応していることが明らかになってきた。
なおチラコイド膜とは、葉緑体内部に存在する内膜系で、光エネルギーを化学エネルギーに変換する光反応の場のことだ。扁平な形状をした胞膜であり、「クロロフィル」や「カロテノイド」を含んだ光合成に関わるタンパク質が多く存在し、膜が1枚ずつ独立した形状をしている場合と複数の膜が重なり多重になっている場合がある。一般的にコケ植物も含め陸上植物では、1枚の胞膜で存在する「ストロマラメラ」と10枚程に重なった「グラナ」と呼ばれる異なる2つの膜構造が発達していることが電子顕微鏡の観察によって確認済みだ。
しかしこれまでの研究のほとんどが、試験管内での解析や葉全体を使った解析だったため、生きた植物細胞の葉緑体内部における実際の様子や振る舞いについては不明な点が多く残っているという。植物の光合成反応は、空気中の二酸化炭素を吸収し、安全な形で有機物を作りだす唯一の自然化学反応であり、近年多くの研究分野で注目されているのはいうまでもない。そこで研究チームは、光合成反応の実態を明らかにするため、植物細胞の葉緑体内部を生きたままで観察して可視化できる技術の開発に挑んだのである。
葉緑体は長径10μm以下と小さいため、その内部を観察することは容易ではない(画像1)。また、光合成反応を調節する多くのタンパク質はクロロフィル色素を含んでおり、その強い蛍光が観察の邪魔になる。
研究チームは、葉緑体の大きさの問題を解決するため、コケ植物「ヒメツリガネゴケ」の原糸体(胞子が発芽した後に形成される糸状の構造)の細胞に着目した(画像2a)。ヒメツリガネゴケは、コケ植物のモデル生物として初めてゲノムが解読された経緯を持つ。成長しても1cmほどにしか育たない。
ヒメツリガネゴケの原糸体細胞は簡素な構造で、細胞1つに約50個の葉緑体が存在しており、薬剤などの処理も容易にできるほか、寒天の培地上に育った細胞を直接観察できるため生体観察に適している。また、原糸体細胞に抗生物質(アンピシリンなど)を投与すると葉緑体の分裂が阻害され、細胞内に通常の約20倍以上のにもなる1つの巨大な葉緑体を形成することが知られている(画像2e)。
こうした特徴を利用することで、より広い空間視野で葉緑体内部を観察できるだけでなく、通常は細胞内を動き回る葉緑体が動かなくなるため、葉緑体内部の観察に適した試料状態にすることができるというわけだ。
また、クロロフィル色素の強い蛍光の問題を解決するため、共焦点レーザー顕微鏡が用いられた。共焦点レーザー顕微鏡は、光源にレーザーを用いる顕微鏡システムである。レーザー光を使って試料を照射し、それによって試料から放出される蛍光を検出。この時、ある特定の波長を持つレーザー光を照射し、特定の光学フィルターを組み合わせて用いることで、試料中に含まれる蛍光物質を選択的に検出することができるのである。また、レーザーを絞ることでスポット状に照射し、焦点面以外からの迷光を遮断するピンホールを用いることで、よりコントラストの高い画像を観察することも可能という特徴を持つ。
まず、共焦点レーザー顕微鏡でクロロフィルの蛍光の観察が行われ(画像2b・f)、得られた3次元蛍光画像のコンピュータ解析により非焦点ボケが除去された(画像2c・g)。こうすることで、クロロフィル色素の強いクロロフィル蛍光を抑えることができ、葉緑体内部の構造をはっきりととらえることに成功したのである(画像2d・h)。
次に研究チームは、コケの巨大葉緑体形成、共焦点レーザー顕微鏡観察、そして画像解析による非焦点ボケ除去の組み合わせによって確立したライブセルイメージング技術を用いて、葉緑体内部の構造の詳細な解析を行った。その結果、チラコイド膜が形成する、1枚の胞膜で存在するストロマラメラと、10枚程に重なったグラナの異なる膜構造を識別することに成功したのである。
前述したように、ストロマラメラは重なりのない1枚の胞膜を、グラナはチラコイド胞膜が数枚重なった構造をしていることはこれまでの電子顕微鏡を使った解析で確かめられており、またストロマラメラが複数のグラナをつなぐような形で存在していることもわかっていた。しかし、これらは化学物質で細胞を固定した上で観察されたものであり、生きた細胞の葉緑体内部でストロマラメラとグラナの2つの膜構造が識別されたのは、今回が初めてのことになる。
さらに、この膜構造の経時的な観察が行われたところ、ストロマラメラは非常に活発に動いている様子が観察されたのに対し、グラナは安定した膜構造を示したという。また、薬剤の「リンコマイシン」を使ってグラナのサイズを小さくすると、膜構造全体の動きが活発化することも観察でき、グラナが葉緑体内部の膜ネットワーク構造の安定性に重要であることも判明したのである。
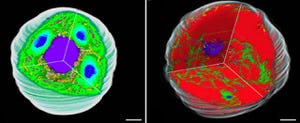
画像3が、ヒメツリガネゴケの葉緑体内部におけるチラコイド膜の構造変化を、時間を追って観察したもの。蛍光強度の違いから3次元構造を推測し、ストロマラメラとグラナが判別された。緑色で示した部分がストロマラメラの構造で、黒色で示した部分がグラナの構造だ。
数字は観察時間(単位は秒)で、7秒以降の各パネルに、1つ前で観察された膜構造を半透明で重ね合わせて表示することで、どれだけ構造が変化したのかを確認できる仕組みである。ストロマラメラは7秒ごとにその形状が大きく変化しているのがわかる一方で、グラナの構造は形こそ変わっているものの位置はほとんど変化していない。
光合成反応を完全に解き明かすことは、人工光合成研究への応用だけでなく、植物の光合成能力の向上や今後起こりうる自然環境変化に植物が生き残るための機能を知る上でも重要なことだという。今回、コケ植物を使い、光合成反応を調節する葉緑体を生きたまま観察できるライブセルイメージング技術が開発され、葉緑体内で起きる膜ダイナミクスの可視化に成功した形だ。この成果は、葉緑体内部の実態を解明する重要な手立てとなるとしている。
今後は、光合成に関わるタンパク質の動きに膜ダイナミクスがどれだけ関与しているのか、またその機能的側面についても明らかにする必要があるという。葉緑体内部の複雑なチラコイド膜構造や光合成反応が起きる空間環境についても明らかにする必要があるとしている。
今回、開発された葉緑体のライブセルイメージング技術を基に、さらに時間と空間の分解能を上げたり、タンパク質の移動速度を測定できたりするようにするなど、解析手法を進化させることで、定量的かつ動態的な変化を追跡することを目指し、光合成調節の分子メカニズムの完全理解へとつなげていくとしている。