北海道大学(北大)、理化学研究所(理研)、高輝度光科学研究センター(JASRI)、東京薬科大学、共和化工 環境微生物学研究所の5者は1月7日、理研とJASRIが共同建設したX線自由電子レーザー(XFEL)施設「SACLA」を用いて、生きた細胞のナノレベルでの観察に成功したと共同で発表した。
成果は、北大電子科学研究所の西野吉則 教授、同・木村隆志 助教、理研 放射光科学総合研究センターの別所義隆チームリーダー(現・客員研究員)、JASRIの城地保昌チームリーダーらの共同研究チームによるもの。研究の詳細な内容は、日本時間1月7日付けで「Nature Communications」に掲載された。
最先端の電子顕微鏡を用いると、物質材料を原子レベルで観察することが現在は可能となっている。ただし、それを生物資料に応用することは困難を極めている。電子線の照射により、生物試料の内部構造が壊れてしまうため、どんなに優れた電子顕微鏡であっても、物質材料と比べると生物試料に対してははるかに分解能が劣るレベルでしか観察しかできないのだ。同じことはX線顕微鏡でもいえる。X線は放射線の1種で非常にエネルギーが高いため、生物資料を損傷してしまうため、分解能が制限されてしまっているのだ。
電子顕微鏡やX線顕微鏡で用いられる線量は、放射線に耐性を持つ微生物すら死んでしまうほど強力であり、生物を生きたまま観察するにはまったく向かない技術なのである。そこでこれらの顕微鏡において放射線による試料損傷を軽減させるための技術として考え出されたのが、生物試料を極低温に保つという手法だ。しかし、試料を極低温で冷凍することで細胞は死んでしまうため、結局のところ、生きた試料をそのまま観察することは不可能だったのである。
また、試料の内部構造を観察できる透過電子顕微鏡では、電子線が試料を透過する能力が極めて低いことから、試料を数100nm以下という薄さにスライスする必要がある。このため、透過電子顕微鏡では、細胞などの厚みのある試料を丸ごと観察することができない。透過電子顕微鏡で観察できるように、細胞を固めて薄切りにすれば、細胞が死んでしまうのはいうまでもないだろう。
さらに顕微鏡観察では、画像のコントラスト(内部構造の見やすさ)も重要な指標だ。細胞などの生物試料の観察では、しばしば試料を染色してコントラストを人為的に高める手法が採られる。この方法では、染色をされた特定の構造はコントラストが強調されて見えるが、それ以外の構造を見ることは困難だ。また、この染色によっても細胞が死んでしまうことがしばしばある。
このように、細胞を微細に観察しようとするのは非常に難しく、従来の顕微鏡技術では、「染色しない生きた細胞を、丸ごと、ナノメートルの分解能で観察する」ということは不可能だった。あえてそれを可能とするには、細胞が損傷を受ける前に、その姿を素早くとらえる手法が必要というわけである。
そして今回の重要な要素となったXFELは、現在、日本のSACLA(SPring-8Angstrom Compact free electron LAser)のほかには米国の1施設LCLSでのみ利用可能な、世界最先端のX線だ(X線の波長はSACLAの方がLCLSの半分ほどで、たったの0.06nmしかない)。
またXFELの発光時間は10フェムト秒以下と、大型放射光施設「SPring-8」からのX線と比較して1000分の1以下の短さだ。フェムト秒は放射線による試料損傷が起こる時間スケールよりも短いため、XFELで試料を照らすと、試料が放射線による損傷を受ける前の一瞬の姿をとらえることが可能なのである。ちなみに、1フェムト秒という時間では、真空中で秒速約30万kmの速度の光ですら、0.3μmしか進めない。
しかし、先行する米LCLSでも、タンパク質の微小結晶やウィルス粒子など、生物試料の測定が行われてきたが、これらの実験では、試料が真空中を飛翔しており、やはり生きた状態を保つことが困難だった。また試料は連続的に打ち出されるため、多量の試料を用意しなければならないという問題もあったのである。
今回の研究では、牛乳の中に生息する「Microbacterium lacticum(M.lacticum)」という、1μmもない位の大きさの微生物細胞を、生きた状態で、ナノメートルの分解能で観察が行われた。この微生物は耐熱性があり、加熱殺菌時に注意が必要な厄介者だ。殺菌は製品の品質保持に関わるため、この微生物の研究は、酪農においても重要性を持つが、大きさが1μm以下と小さいため、通常の光学顕微鏡で内部構造を観察するのが困難である。
そこで研究チームは今回、「パルス状コヒーレントX線溶液散乱(PCXSS)法」と名付けられた独自に考案された手法を用いて、生きた細胞の観察に挑戦したというわけだ。画像1は、PCXSS法の模式図である。
PCXSS法は、自然な状態にある溶液試料を測定できるのが特徴だ。これは、生物試料を「マイクロ液体封入アレイ(MLEA)チップ」と呼ばれる、研究チームが独自に開発をしたデバイスに入れることで実現する。MLEAチップ内に封入された生物試料は、冷却、染色、切断されることなく、真空に晒されることもないため、細胞が生きている状態を保つことが可能で、その上でXFELの照射を受けることができるというわけだ。
生物が生きていくためには水が必須なのはいうまでもないが、溶液状態で測定を行えるということは、生物試料にとってはまさに理想的だとする。前述したが、XFELは発光時間が非常に短いため、試料が放射線による損傷を受ける前に、この理想的な状態にある生物試料の姿をとらえることができるのだ。
研究チームは、まずMLEAチップ中で生きた細胞を閉じ込められることを、蛍光顕微鏡を使って確認することからスタート。画像2が、蛍光顕微鏡観察の結果を示したものだ。蛍光顕微鏡観察実験では、生きている細胞は緑色に、死んでいる細胞は赤色に光るように処理が施された。画像2に示されているように、MLEAチップ中に細胞が封入されて、真空中に1時間も置いた後でも、ほとんどの細胞が生きていることが確認されている。この実験により、MLEAチップを用いたPCXSS法測定によって、生きた細胞の観察が可能であることが示されたというわけだ。
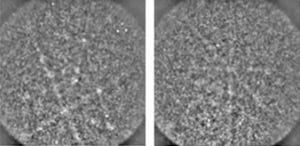
SACLAを用いたPCXSS法測定では、集光鏡を用いてXFELがマイクロメートル程の領域に集められ、MLEAチップ中の生きた細胞に照射が行われた。そして、細胞からのコヒーレントX線回折パターンが、マルチポートCCD検出器によって計測された。画像3が、1匹の生きた細胞に、XFELを1発照射して計測したコヒーレントX線回折パターンを示したものだ。細胞の形に由来した、綺麗な干渉縞が1方向に延びているのが見て取れる。
なお、波面(波長)が揃っている光のことをコヒーレント光といい、レーザー光もそれを特徴の1つとする。SACLAならではのコヒーレントX線を試料に照射した際に起こるX線の散乱現象が、コヒーレントX線回折だ。コヒーレントX線回折パターンは、試料のわずかな構造の違いにも敏感なのが特徴である。コヒーレントX線回折パターンをコンピュータで解析すると、試料の画像を得ることができるというわけだ。
PCXSS法では、対物レンズの代わりにコンピュータを用いて、コヒーレントX線回折パターンの測定データから、試料像を復元する仕組みである。性能のよいX線用対物レンズを作ることは技術的に困難なため、対物レンズを用いないPCXSS法により、高分解能での観察を実現したというわけだ。
また、X線は透過性に優れ、染色をしない細胞を素通りしてしまうため、染色をしない細胞はX線にとって透明な物体だ。ヒトの目で透明な空気を観察するのが困難なように、通常の顕微鏡では透明な試料の観察が困難だが、コヒーレントX線回折を用いることにより、透明な試料の内部構造も、高いコントラストで鮮明に観察できるのである。
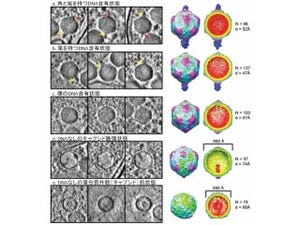
画像4が、生きた細胞からのコヒーレントX線回折パターンから、コンピュータを用いて復元した、生きた細胞の画像だ。この細胞の画像には、極めて興味深い特徴を見ることができるという。細胞の下部には、ダンベル型をした画像強度の高い部分が存在する。この領域は、X線散乱強度の強い、DNAなどの物質で構成されていることが示唆されるという。実際に、細胞下部の画像強度の強い部分は核酸で構成され、それ以外の部分はタンパク質で構成されていると仮定すると、画像強度の高い部分とそれ以外の部分の強度比を、定量的にほぼ説明することが可能だ。
そして画像5が、比較のために透過電子顕微鏡で観察したM.lacticumの画像。この細胞の画像の特徴は、今回XFELを用いて観察した画像と似ているのがわかる。ただしここで強調すべきことは、透過電子顕微鏡による測定では、細胞を樹脂で固め、100nm以下の厚さにスライスし、酢酸ウランとクエン酸鉛という重金属塩で染色するという複雑な処理をしているという点だ。このような処理をした細胞の透過電子顕微鏡像を、定量的に解釈することは困難だとしている。

|

|
|
画像4(左):XFELを用いて計測したコヒーレントX線回折パターンをデータ解析して得た、生きているM.lacticum細胞の画像。 画像5(右):Microbacterium lacticum細胞の透過電子顕微鏡像。細胞を樹脂で固め、100nm以下の厚さにスライスし、酢酸ウランとクエン酸鉛という重金属塩で染色するという複雑な処理を施して得られたものだ |
|
研究チームが世界に先駆けて今回開発した、XFELを用いたPCXSS法は、染色しない生きた細胞を、ナノメートルの分解能で定量的に観察できる優れた手法だ。今後、生きた細胞を系統的に測定することで、未だ解明されていない原核微生物のゲノム複製やそれに続く細胞分裂などの、重要な細胞内現象の解明につながると期待されるという。
また、XFELの集光度をさらに向上させることにより、より小さな生体分子の観察や、さらなる分解能の向上も期待されるとする。これにより、従来の結晶構造解析などでは見ることのできなかった、自然な状態にある溶液中の生体分子のナノ構造を観察できると期待されるという。生体分子のナノ構造の解明は、生命現象の理解や医学への応用へとつながり、ライフイノベーションにも貢献するとしている。