東京大学は9月26日、国際医療福祉大学、自治医科大学との共同研究により、脳や脊髄のニューロンのみに「ADAR2(Adenosine deaminase acting on RNA2)」遺伝子を発現させる「アデノ随伴ウイルス(adeno-associated virus:AAV)」ベクターを開発し、このベクターを「孤発性ALS(Amyotrophic Lateral Sclerosis:筋萎縮性側索硬化症)」の病態を示すモデルマウスの血管に投与したところ、その「運動ニューロン」の変性と脱落、および症状の進行を食い止めることに成功したと発表した。
成果は、IUHW 臨床医学研究センターの郭伸 特任教授(東大大学院医学系研究科 附属疾患生命工学センター 臨床医工学部門 客員研究員兼任)、東大大学院医学系研究科 附属疾患生命工学センター 臨床医工学部門の山下雄也特任研究員、自治医大の村松慎一特命教授らの研究チームによるもの。研究の詳細な内容は、9月24日付けで欧州の医学専門誌「EMBO Molecular Medicine」オンライン版に掲載された。
ALSは運動ニューロン(大脳皮質運動野の上位運動ニューロンと脳幹脳神経核や脊髄前角の下位運動ニューロン)が変性、脱落することで起こる進行性の筋力低下や筋萎縮を特徴とする神経変性疾患である。主に中高年に発症し、有効な治療法はなく数年の内に呼吸筋麻痺により死に至る神経難病で、大多数は遺伝性のない孤発性ALSだ。
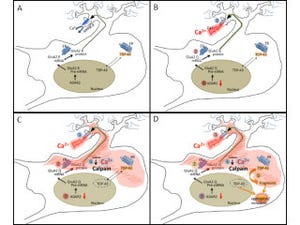
これまでの研究で、郭特任教授らの研究チームはALSでは興奮性神経伝達に関わる「グルタミン酸受容体」の1種である「AMPA受容体」の異常が運動ニューロン死の原因であることを突き止めていた。AMPA受容体はイオンチャネルの開閉により神経の興奮を制御する仕組みで、ほとんどのニューロンがAMPA受容体を発現し、その大多数はカルシウムイオンを透過しない。孤発性ALSでは異常にカルシウム透過性が高いAMPA受容体が発現することがわかっている。
AMPA受容体の異常をもう少し具体的に説明すると、AMPA受容体にはカルシウム透過性を規定するサブユニットである「GluA2」がある。本来、GluA2に生ずべきRNA編集(転写後の一塩基置換)が起こらないと未編集型GluA2が発現し、カルシウム透過性が異常に高いAMPA受容体が運動ニューロンに発現してしまう。そのことに加えて、GluA2が未編集となるのはRNA編集酵素であるADAR2酵素の発現低下のためであることが確かめられていたのである。なおRNA編集(転写後の一塩基置換)とは、遺伝子のDNAがRNAに転写された後、RNA塩基に変化が起こることの総称で、この場合はアデノシンがイノシンに変換する脱アミノ基の反応(A-I置換)を指す。
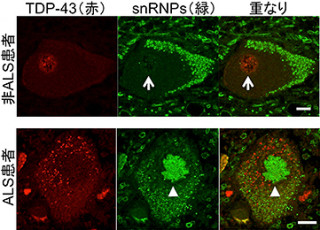
さらに、緩徐な運動ニューロン死による進行性運動麻痺を呈する、孤発性ALSの表現型を再現する唯一の分子病態モデルマウスであるADAR2のコンディショナルノックアウトマウス(AR2マウス)の解析から、ADAR2酵素の発現低下は、異常なカルシウム透過性AMPA受容体の発現を引き起こすことにより運動ニューロン死の直接の原因であることも証明。孤発性ALSの運動ニューロンで起きる「TDP-43(TAR DNA binding protein of43kDa)」の局在異常(TDP-43病理)を引き起こすことからも、この分子異常が孤発性ALSに病因的意義を持つことを研究チームは示してきたというわけである。
TDP-43は、RNA結合タンパクでALSの運動ニューロンに異常な物質の集積により形成される構造体(封入体)の構成要素だ。そしてTDP-43病理とは、孤発性ALSの大多数の症例やある種の家族性ALSではこの封入体と同時に正常な局在部位である核からTDP-43の喪失が運動ニューロンに観察されることをいう。そのため、TDP-43病理はALSの病理学的指標になっているというわけだ。
前述したようにALSには有効な治療法がなく、死に至る難病であるため、根本的な治療法が切望されている。そのためには遺伝子治療は有効な手段の1つと考えられ、研究が世界中で進められているところだ。ALSに対して遺伝子治療を行う場合には、脳幹や脊髄全体に治療遺伝子を行き届かせる必要があるため、静脈注射や髄腔内投与による遺伝子の送達が望まれる。しかし、投与した遺伝子は脳幹や脊髄にたどり着くまでに血液脳関門を通らなければならないため、効き目のある量を脳幹や脊髄で発現させることが困難だった。
また、静脈注射や髄腔内投与では、遺伝子が目的とする運動ニューロンだけではなく全身に発現するため、目的とする脳幹や脊髄以外での遺伝子発現のため副作用を生ずる可能性が高く、両者を両立させることはこれまで課題となってもいたのである。そこで、血管内に投与した場合でも脳や脊髄内の神経細胞(ニューロン)だけに遺伝子が発現するウイルスベクターが開発されたというわけだ。今回の研究では、このウイルスベクターにADAR2遺伝子が組み込まれ、孤発性ALSの病態を示すモデルマウスの静脈に投与する遺伝子治療が行われ、その効果が検討されたのである。
アデノ随伴ウイルス(AAV)はヒトの脳内投与、全身投与で安全に遺伝子を送達できるウイルスとして世界的にも遺伝子治療の臨床試験に用いられているウイルスだ。研究チームは今回、治療遺伝子を安全かつ効果的にALS患者の病症部位である脳幹や脊髄に届けることができるAAVベクターを開発。マウスの静脈内投与により約20%以上の確率で脊髄運動ニューロンに治療遺伝子ADAR2を到達させ、発現させることに成功した。
遺伝子はニューロンのみに発現するため、肝臓や血液などの中枢神経のニューロン以外では発現せず、ADAR2遺伝子が発現することによるニューロンやその周囲の組織の異常な反応も見られず、副作用も認められないという。そのため、ヒトでも安全に全身投与できるADAR2遺伝子ベクターであることが期待されるとする。
研究チームは孤発性ALSの病態を示すAR2マウスでは、ALSに特有な運動機能障害、選択的な運動ニューロン死、ALSに特異的なTDP-43病理が観察されることを明らかにしており、このマウスにRNA編集酵素ADAR2遺伝子を組み込んだ上記のAAVベクターを投与し、遺伝子治療の効果を検討した。
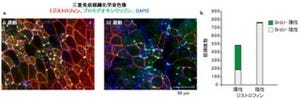
すると、脊髄運動ニューロンへの遺伝子導入が確認され、モデルマウスへの投与から2カ月で運動機能の低下が抑えられることが確認されたのである(画像1)。投与7箇月後のモデルマウスでは、ADAR2遺伝子を組み込んだAAVベクターを投与していない対照群と比較して、脊髄のADAR2発現が1.5倍に上昇し、カルシウム透過性AMPA受容体の発現を意味する未編集型GluA2の発現が減り、「脊髄前根」(脊髄のほぼ全長にわたって、脊髄の前面から出る脊髄神経の束)の軸索数や運動ニューロンの細胞数の減少で表される運動ニューロンの変性や脱落が抑制されていた。また、ALSに特有なTDP-43の異常な局在変化が軽減され、核がTDP-43陽性の正常な運動ニューロン細胞数が増加したのである。
上記の結果は、ADAR2遺伝子の導入によりADAR2活性が回復し、異常なカルシウム透過性AMPA受容体の発現が抑えられた結果、運動ニューロン死が阻止されたことを意味しているという。AAVベクターを投与してADAR2遺伝子を発現させたことによる異常なグリア細胞の反応は確認されていない。これらの解析結果は、孤発性ALS患者でも発現が低下しているADAR2を正常化することで、治療効果が得られる可能性があることを示唆するとする。
これまでALSには根本的な治療法がなかったが、今回の成果によりALS患者の大多数を占める孤発性ALSの治療実現への道筋が拓かれたといえよう。この治療法は副作用や患者への治療行為への危険を軽減するために血管内へウイルスベクターを投与し、脳や脊髄の神経細胞のみに治療遺伝子を発現させることを視野に入れた治療法で、1回の静脈注射で長期間の効果が得られる利点もある。
今回改良したウイルスベクターを用いれば脳や脊髄のニューロンに広範囲に治療遺伝子を導入できるようになるため、ALS以外の中枢神経系疾患に対してもより簡便な遺伝子治療を提供できる可能性があるという。今後、このウイルスベクターを用いたADAR2遺伝子導入の安全性の問題や効果が最も得られる用量などを解決することにより、ヒトへの応用が可能になり、ALSなどの神経難病の治療法としての臨床応用が期待されるとしている(画像2)。