科学技術振興機構(JST)、東京工業大学(東工大)、東京大学の3者は8月1日、ホタル発光酵素の反応機構を利用して、タンパク質同士の相互作用を迅速、簡便、高感度に検出できる新技術の開発に成功したと共同で発表した。
成果は、東工大 資源化学研究所の上田宏教授(前・東大大学院 工学系研究科 准教授)らの研究チームによるもの。研究はJST先端計測分析技術・機器開発プログラムの一環として行われ、詳細な内容は米国時間8月1日付けで米科学誌「Analytical Chemistry」に掲載された。
ヒトゲノムとそこに指定されるタンパク質の配列が明らかになってから、約10年が経過した。しかし、生命の神秘はいまだに解き明かされておらず、さまざまな病気の原因も不明なままだ。その一因として、タンパク質の機能、特にタンパク質同士の相互作用についての理解が不十分なことが挙げられるという。現在、ヒト細胞内には、15~30万種類のタンパク質間相互作用が存在するといわれている。これらの時間的・空間的な変化やその制御機構の理解は、生命現象の解明に不可欠であるのみならず、疾患治療薬の開発などの応用研究開発を進める上でも極めて重要だ。
従来より研究や薬物探索の分野においては、相互作用を分析したい目的タンパク質に、ほかの発光タンパク質のパーツなどを融合して細胞に発現させ、相互作用の有無による発光強度の変化を検出する方法が採られてきたが、この方法では、パーツのつなぎ方に試行錯誤が必要という問題があった。
そのほかにも、細胞内外でタンパク質同士の相互作用を検出する技術は複数あるが、分析したい相互作用のみを感度よく確実に検出するためには、測定の前処理や準備などに多くの試行錯誤が必要だ。そのため従来法では、熟練した技士の手でも測定結果を得るまでに数時間から数日を要するため、迅速・簡便に目的の相互作用を分析できる新技術の開発が求められていたのである。
またホタルの発光酵素「ルシフェラーゼ」はホタルの生物発光の源となる酵素で、多くの人々によって、その反応機構と構造が解析されてきた。近年、ルシフェラーゼは1つの酵素であるにも関わらず、その構造を変化させながら2つの半反応を行うことが解明されている。
ルシフェラーゼは、「N(アミノ)末」側と「C(カルボキシ)末」側の2つの領域(ドメイン)からなる酵素で、基質である「ルシフェリン」と反応して光を発する仕組みだ。その際、最初にN末側ドメインがエネルギー物質の「アデノシン三リン酸(ATP)」を用いて、ルシフェリンを「アデニル化」(基質に高エネルギーな「アデノシン1リン酸(AMP)」を付加する反応)させて反応中間体に変化させる(1段階目の半反応)。次にC末側ドメインが140°回転して、その中間体を受け取り、「酸化的発光反応」を行う(2段階目の半反応)。
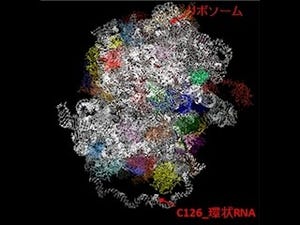
画像1がホタルルシフェラーゼの触媒する2つの半反応と、それぞれの反応時における体構造モデルだ。C末ドメイン(赤)が140°回転することにより、それぞれの活性部位を形成。各反応においてカギとなる残基(Lys529、Lys443/His245)に変異が導入されている。
研究チームは以前より、ルシフェラーゼのN末側ドメインを用いて反応中間体の定量法を開発し、さまざまなルシフェラーゼ変異体の反応解析を行ってきた。その際、2段階目の半反応(発光反応)のみが遅い変異体「H245D」があることが発見されたのである。
この知見から、1つの半反応のみが効率よく行われ、別の半反応が行われないような変異体同士を相補的に組み合わせれば、反応中間体の受け渡しが起こり、各変異体単独では見られない発光反応を検出できるのではないか、と考察したという。
つまり、それらの変異体と分析対象のタンパク質をそれぞれ融合して発現し、基質を加えて発光が見られる場合、変異体同士が十分に近づいてルシフェラーゼ本来の機能が再構成されたことを示すので、分析対象のタンパク質同士が相互作用することの証明となると考えたというわけである。
この仮説を検証するため、研究チームはまず、相互作用タンパク質ペアの例として、「FKBP12」と「FRB」という2種類のタンパク質を用いることにした。これらは、「ラパマイシン」という分子が存在する場合のみ、相互作用することが知られている。
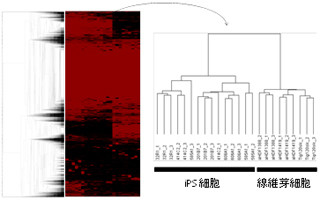
そこで研究チームは、FKBP12に、中間体を効率よく生成するがそれ自身はほとんど発光しないルシフェラーゼ変異体(中間体ドナー)を、FRBには微量の中間体で効率よく発光するがルシフェリンとは弱くしか発光しないルシフェラーゼ変異体(中間体アクセプター)を遺伝子的に結合させ、大腸菌で発現させることにした(画像2)。FKBP12に結合した中間体ドナーが産生するアデニル化基質は酵素の近くで高濃度に存在するため、FRBに結合した中間体アクセプターが近接した場合にその発光強度がより高まるという仕組みである。
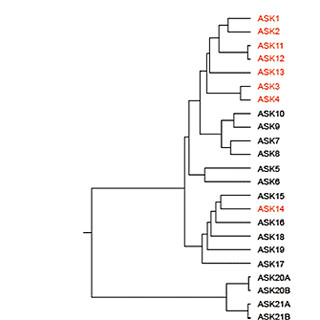
「FKBP12に結合した中間体ドナー」と「FRBに結合した中間体アクセプター」の混合溶液に、基質であるルシフェリンを加えたところ、弱い発光しか見られなかったという。一方、ルシフェリンと共にFKBP12とFRBの相互作用を促すラパマイシンを加えた場合は、基質添加後1秒以内に発光強度が濃度依存的に顕著に(最大25倍以上)上昇し、その検出感度も十分高いことが明らかとなった(画像3)。さらに相互作用抑制効果のある抗生物質「FK506」を加えた場合には、発光が顕著に弱まったことから、この発光上昇は相互作用するタンパク質ペアでのみ起きることがわかるというわけだ。
また、ほぼ同じタンパク質を培養細胞(「Cos-7細胞」あるいは「293T細胞」)に発現させた場合にも同様のラパマイシン依存的発光が見られたという。この結果は、今回のホタル発光中間体に基づく相互作用検出法「FlimPIA(Firefly luminescent intermediate-based Protein Interaction Assay)」が細胞内外で利用可能なことを証明するものだとした。
画像3は、FlimPIAの測定結果。「FKBP12に結合した中間体ドナー」と「FRBに結合した中間体アクセプター」が同濃度で混合された溶液中において、同じく濃度の等しいラパマイシンの有無による度比の時間変化を示したものだ。基質添加後1秒以内に最大のシグナル/バックグラウンド比が得られている。750nM+FBSは40%ウシ血清存在下での測定結果。
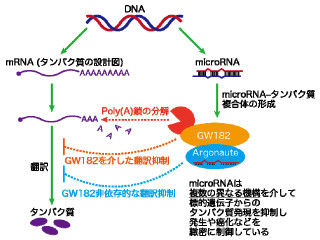
FlimPIA法の有用性を実証するため、細胞のがん化に関与する2つのタンパク質「p53」と「mdm2」の相互作用についても測定が行われた。その結果、試験管内で両者の相互作用に依存的な発光増大を観察することができたという(画像4・5)。さらに、既知の相互作用阻害剤(Nutlin-3)の添加によって、その発光が抑制されたとした。この結果は、この反応の特異性を示すのみならず、この技術が新たな薬物探索にも応用できる可能性を示すものだ。
FlimPIA法は、従来の酵素を2つの断片に物理的に分割してそれらの再構成を検出する相互作用検出法「PCA(Protein-fragment Complementation Assay)」に比べ、精製したプローブの発光強度と安定性において数倍以上優れており、試験管内での簡便迅速な検出系として幅広い利用が期待されるという。
FlimPIA法は、細胞内外を問わずに活用できる高い有用性を示すのみならず、従来法よりも迅速に感度よくタンパク質間相互作用の検出を可能とするものだ。今後も、特に中間体アクセプターを改良することによって、バックグラウンドの発光値を下げ、検出感度をさらに向上させることが期待できるという。将来的に、FlimPIA法によるタンパク質間の相互作用検出は、より感度が高く効率のよい薬剤スクリーニングへの応用が期待されると共に、脂質代謝酵素など類縁酵素の活性制御などへの応用も考えられるとしている。