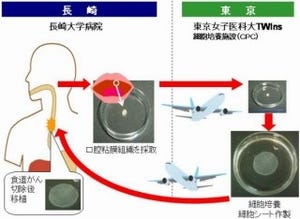
京都大学は7月25日、100年来の謎であった「プラナリアの再生の仕組み」を分子レベルで解明し、プラナリアの再生原理を理解することによって、もともと再生できないプラナリア種の遺伝的原因を解明し、人為的に再生を誘導することにも成功したと発表した。
成果は、京大 理学研究科の阿形清和教授、徳島大 ソシオテクノサイエンス研究部の梅園良彦学術研究員(2013年3月まで理化学研究所)らの共同研究チームによるもの。研究の詳細な内容は、日本時間7月25日付けで英科学誌「Nature」オンライン速報版に掲載された。
体をどんなに切られても再生できる不死身で不思議な生き物「プラナリア」。プラナリアには幹細胞が全身に存在し、体の位置情報に従って失われた器官や組織を正しく再生することができることから、そんな不死身ぶりを発揮することが可能なのである。
そうした不死身のプラナリアの中でも「ナミウズムシ」は再生能力が高く、例えば、体を前後に切られても、頭部からは首と腹と尾が、尾部からは頭と首と腹が再生し、その結果、完全な2匹のプラナリアとなるのは、理科好きでない人でも1度は聞いたことのあると思う。
今から100年以上も昔に、トーマス・ハント・モーガン(1933年にショウジョウバエ遺伝学でノーベル生理学・医学賞を受賞)が、このプラナリアの再生の謎解きに挑み、何らかの「物質の濃度勾配」が体の前後の位置情報をコードしているのではないかという仮説を提唱し、その後、この発想はあらゆる生き物の形づくりを理解するための基本概念として世界中の研究者に支持されるようになった。
しかしその一方で、プラナリアの再生の仕組みにおいて、モーガンの仮説が正しいかどうかは、実は今もって謎のままだったのである。そこで研究チームは今回、「プラナリアの再生の仕組み」を分子レベルで解明することに挑んだというわけだ。
2011年、梅園研究員らは、プラナリア幹細胞が未分化状態から外れて、さまざまな細胞種へと分化するためには「ERKタンパク質」の活性化が必要であることを明らかにした。一方で、「Wnt/β-カテニン経路」が後方化シグナルとして働き、プラナリア尾部再生に必要であること(β-カテニン遺伝子をRNA干渉法(RNAi)によって機能阻害すると、本来の尾部が頭部へと運命転換する)が報告されていたため、この2つのシグナル経路の組み合わせで「プラナリアの再生の仕組み」が説明できるのではないかと推測したのである。
そこで梅園研究員らは、ナミウズムシ再生過程の詳細な解析を行った。その結果、ERKタンパク質とβ-カテニンタンパク質は体の前後軸に沿って相反する活性勾配を形成し、その結果、体の異なる領域(頭、首、腹と尾)が再生できると結論づけたのである。
この仕組みにおいて、同研究チームが2002年に報告した「nou-darake(ノウダラケ)遺伝子」(この遺伝子をRNAiによって機能阻害すると、脳が頭部を超えて過形成する)も関与することが判明。これらの結果から、プラナリアの幹細胞はERKタンパク質の活性化によって、もともと頭部の細胞に分化するように指令されるが、nou-darake遺伝子やWnt/β-カテニン経路がERKタンパク質の活性化レベルを抑制することによって、その指令を首や腹や尾部の細胞へとそれぞれ運命転換させていると結論づけたのである。
画像1は、プラナリアの再生原理。ERK活性化レベルは頭部で最も高く、首部ではnou-darake遺伝子によって低くなっている。腹部および尾部では、ERK活性化レベルはβ-カテニン活性によって、さらに低くなっていて、その結果、頭尾軸に沿って勾配を形成していると考えられた。nou-darake遺伝子およびβ-カテニン活性を阻害すると、ERK活性勾配は形成されなくなり、その結果、すべての領域が頭部に運命転換してしまう。
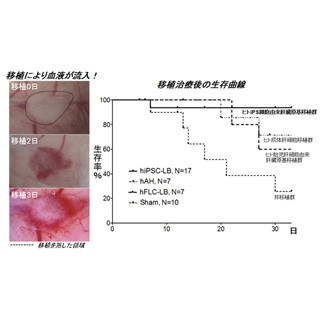
さらに、梅園研究員らはナミウズムシの再生原理に基づいて、別種のプラナリアである「コガタウズムシ」(もともと尾部から頭部を再生できないプラナリア)では、Wnt/β-カテニン経路が過剰に働くことが頭部再生不全の原因であることを実験的に証明した。β-カテニン遺伝子をRNAiによって機能阻害されたコガタウズムシ尾部断片は、完全に機能的な頭部を再生することができたのである(画像2・3)。

|

|
|
コガタウズムシ尾部断片からの頭部再生誘導。画像2(左):正常な尾部断片。頭部をまったく再生することができない。画像3:β-カテニン遺伝子をRNAiによって機能阻害された尾部断片。白い部分が再生した頭部。1対の眼が確認できる |
|
今回、研究チームは100年来のモーガンの仮説の大枠を分子レベルで実証したばかりでなく、再生できないプラナリアの遺伝的原因を初めて明らかにし、再生できない生き物でも、実は再生できる能力を十分に持っていることを初めて実験的に証明した。
また今後の課題としては、プラナリア幹細胞において、どのようにしてERKシグナルが活性化しているのか、また、どのようにして、nou-darake遺伝子やWnt/β-カテニン経路がERKシグナルに対して抑制的に働いているのかを明らかにすることを挙げている。