東京大学(東大)は6月4日、東北大学、東京工業大学(東工大)、産業技術総合研究所(産総研)との共同研究により、生体内の「エネルギーの通貨」などと呼ばれる「アデノシン三リン酸(ATP)」の量を診断し、細胞内でのみ選択的に薬剤を放出できるナノチューブ型分子ロボットの開発に成功したと発表した。
成果は、東大大学院 工学系研究科 化学生命工学専攻の相田卓三 教授(理化学研究所 創発物性科学研究センター 副センター長兼任)、同・博士課程のBiswas Shuvendu氏、東北大 多元物質科学研究所の金原数 教授、東工大大学院 生命理工学研究科 生体分子機能工学専攻の田口英樹 教授、同・丹羽達也 助教、産総研 光技術研究部門の石井則行 主任研究員、東大大学院 工学系研究科マテリアル工学専攻の片岡一則 教授、東大大学院 医学系研究科 附属疾患生命工学センター臨床医工学部門の宮田完二郎 准教授、同・渡邉秀美代 特任研究員らの研究チームによるもの。研究の詳細な内容は、6月2日付けで英科学誌「Nature Chemistry」に掲載された。
核酸医薬はDNA・RNAからなる医薬品で、病気を引き起こす遺伝子やタンパク質に直接作用するため高い効果と低い副作用が期待されている。しかし、細胞試験などでは有望な結果が多数得られているものの、実際に生体に投与すると、がん細胞などのターゲットに届く前に分解されてしまい、一切役割を果たすことができないという大きな問題があった。それを解決するためにも、不安定な薬剤を安定に腫瘍細胞へ配達できるようなドラッグデリバリシステム(DDS)の開発が強く求められてきたが、未だに難しいのが実情だ。
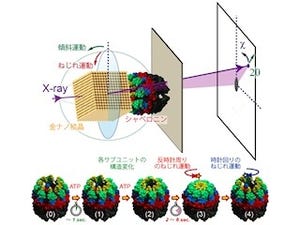
相田教授らは、これまでタンパク質のフォールディングを助ける筒状のタンパク質複合体「シャペロニン」を、1次元チューブ状に集合させる研究を行ってきた。特に相田教授らが注目したのは、シャペロニンの3つの性質だ。1つ目は、変性タンパク質などのゲスト分子を自身の空孔に取り込むことができる性質。2つ目は、生体内に偏在するATPをエネルギー源として機械的構造変化を起こす性質。そして3つ目は、安定で容易に分解されない性質である。
相田教授らは、これまで異分子をシャペロニンに内包させた状態でシャペロニンを1次元状に集合させ、ナノチューブを形成できることを見出してきた。そして今回、相田教授らがこれまでに開発してきたナノチューブがATPの濃度を診断し、細胞内選択的に薬剤を放出できることが確認されたのである。今回の研究では、大腸菌由来のシャペロニン「GroEL」が使用された。
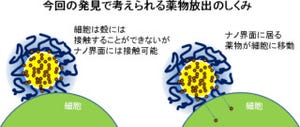
シャペロニンに取り込まれた薬剤が放出されるには、チューブ構造が壊れる必要がある。そのカギとなるのが、ATPをエネルギー源として消費することで引き起こされるシャペロニンの機械的運動と、シャペロニンが形成するチューブ状集合構造だ。
チューブ構造に取り込まれた個々のシャペロニンの機械的運動ではチューブ構造を破壊するには不十分で、より大きな機械的力を生むためには複数の分子が協同的に運動する必要があり、そのためには高濃度のATPが不可欠である。つまり、薬剤放出が開始されるには然るべきATPの濃度が必要というわけだ。
そしてATPは細胞内において1.10mMの高濃度なのに対し、細胞外マトリックスにおいては5μM程度と低い。この濃度差と、上記の放出機構を利用することで、細胞外では薬剤を放出せずに、細胞内でのみ薬剤を選択的に放出する分子ロボットの開発に成功したのである。
また、シャペロニンナノチューブは本来、細胞には取り込まれないという弱点があったが、そこは「ボロン酸誘導体」で表面を修飾することで細胞への取り込みに成功した。
さらにチューブのような異方的な構造は、「EPR(Enhanced Permeability and Retention)効果」によって腫瘍組織に取り込まれやすいという利点も報告されている。EPR効果とは、腫瘍細胞における新生血管に存在する隙間より、通常の血管では通過できないような大きなものも通過できることをいう。そのため、高分子薬剤などが選択的に集積するのだ。
実際に今回の実験でナノチューブ型ロボットをマウスに投与すると、ERP効果により、肝臓細胞に次いでがん細胞に多く取り込まれることが判明している。基本的にほとんどの異物は肝臓にて濾過されてしまうことを考慮すると、今回の結果はDDSとして有望な結果といえるという。
なお、今回用いた薬剤は安定なものであり、ナノチューブ型ロボットでなければ配達できないものではない。しかし、シャペロニンはその構造的安定性が高いため、シャペロニン内に取り込まれた薬剤がどのようなものであっても安定に腫瘍細胞に配達できることが期待されるという。今回の結果を基に相田教授らは、将来的にはがん治療薬として期待される「siRNA(small interfering RNA)」などの不安定な核酸医薬をシャペロニンに取り込み、腫瘍細胞に配達できるシステムの開発を目指すとしている。
また、今回の系はシャペロニンという分子の機械的な運動を薬剤放出のドライビングフォースとして利用しているが、このようにナノメートルのスケールでは、ほとんどの場合熱的なランダムな運動に勝てず、機械的な運動を取り出すことはできない。シャペロニンのように、非常に安定で固い物質において、複数のサブユニットの協同的な動きがあって初めて実現できるものだ。
このように、生体内には人類の科学技術をもってしても、未だに実現の可能性の見えないような複雑で多機能な材料・系がいくつもある。そのようなものを人類が一から設計できるようになるにはまだまだ時間がかかるが、今回の発見のように、生体によって作り上げられたものを最大限利用することで、これまでにない新しいシステムを開発することは可能であり、相田教授らはこれからもそうした形での開発を目指していくとした。