東京大学は5月28日、大阪バイオサイエンス研究所との共同研究により、脳神経回路構造が比較的シンプルであるショウジョウバエを解析モデルとして採用し、独自に確立した生体イメージング手法と分子遺伝学的手法を組み合わせることにより、「不要な神経回路の選択的除去」を担うメカニズムに挑んだ結果、神経突起局所で自発的に発生する「低頻度カルシウム振動」明らかにしたと発表した。
成果は、東大大学院 理学系研究科 生物科学専攻の榎本和生教授(大阪バイオサイエンス研究所 研究部長兼任)、大阪バイオサイエンス研究所の金森崇浩研究員らの研究チームによるもの。研究の詳細な内容は、日本時間5月31日付けで米科学誌「Science」に掲載された。
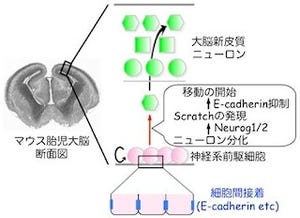
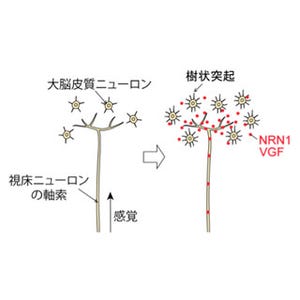
ヒトの脳では、「軸索」と「樹状突起」という機能・構造的に異なる2種類の神経突起を介して、1000億個ものニューロンがネットワークを形成している。ヒト脳神経回路の大まかなネットワークは胎児期に形成される仕組みだ。胎児期に生み出された神経細胞群は適切な場所へと移動した後、神経突起を介してネットワークを構築する。発生初期の幼弱な回路は、いわゆる「混線状態」にあり、その後の発達段階において不要回路の切断・除去を含むネットワークの再編が起こることにより、機能的な情報処理回路へと成熟する(画像1)。
除去過程では、不要な突起のみが選択的に変性・除去される一方で、必要な回路は維持されることが重要だが、ニューロンが自らの突起群の中から「要」「不要」を選択する機構は長らく謎のままだった。その理由として、従来のネコやマウスなど哺乳動物を個体モデルとする研究では、不要回路の除去過程をリアルタイム追跡することが技術的に不可能であり、また分子生物学的手法により分子基盤を同定することも困難であったことが挙げられる。
榎本教授の研究チームは今回、これまでに得てきたノウハウを用いて、独自の生体イメージング手法と分子遺伝学的手法を組み合わせることにより、局所性カルシウムシグナルが、不要な神経回路の選択的除去を担うことを明らかにした(画像2)。
具体的には、オワンクラゲ発光タンパク質GFPにカルシウム結合タンパク質カルモジュリンのカルシウム結合ペプチドを付加したカルシウム感受性人工タンパク質「GCaMP3」をショウジョウバエのニューロンに発現させて、細胞内カルシウム動態を1神経突起レベルの高感度で観察。その結果、神経回路の再編が起きる時期特異的に、神経突起の局所において低頻度カルシウム振動(約1分間に1回程度濃度が上下する)が発生していることが発見された(画像3)。
さらに10時間にわたるリアルタイム連続観察から、カルシウム振動を発生した突起は、必ず3時間後に変性し、ニューロンから除去されることが判明。これに対して、カルシウム振動が起きない突起は、変性することなく、そのまま維持されることがわかったのである。
この低頻度カルシウム振動は、突起上の「電位依存性カルシウムチャネル(VGCCs)」を介して発生しており、VGCCs遺伝子をノックアウトすると低頻度カルシウム振動は消失し、同時に不要突起の除去も起こらなくなることが判明した。従って、神経突起局所において発生する低頻度カルシウム振動は、数時間後に除去される運命にある突起を時間・空間的に規定することが明らかになったのである。さらに、カルシウムシグナルの下流で働く因子群の網羅的検索が行われ、カルシウム依存的タンパク質切断酵素「カルパイン」が同定された。
最近の研究から、脳神経回路の機能成熟過程の異常は自閉症や統合失調症などの一因となる可能性が示されており、今回の成果は、将来的に発症メカニズムの解明や、診断法や治療法の開発に貢献することが期待されるという。
また、カルパインはこれまでに多くの精神疾患との関わりが指摘されてきたが、ほ乳類では15種以上のカルパインが存在し、基質特異性が重複するため個体レベルの解析が難しく、脳神経系における生理的機能および病理的機能の解明は十分なされていない状況だ。
しかしショウジョウバエにはカルパイン遺伝子が2つしか存在せず、遺伝学的解析が容易であるため、今後、カルパインの時空間制御機構や生理的基質、および関連機能因子群を網羅的に明らかにすることにより、将来的に精神疾患の予防や治療につながる成果が期待できるとしている。