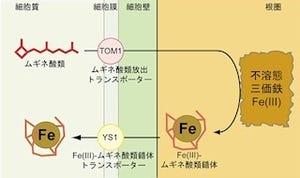
東京大学は5月24日、福岡大学、名古屋大学(名大)との共同研究により、好熱性古細菌の1種「Archaeoglobus fulgidus」に由来する、「陽イオン-カルシウム交換輸送体(Cation/Calcium antiporter:CaCA)」ファミリに属する「プロトン(水素イオン)-カルシウム交換輸送体(CAX_Af)」の立体構造を、X線結晶構造解析の手法を用いて、2.3Åの高分解能で明らかにしたと発表した。
成果は、東大大学院 理学系研究科 生物化学専攻の濡木理教授、同・石谷隆一郎准教授、同・西澤知宏特任助教、福岡大医学部 薬理学教室の岩本隆宏教授、同・喜多紗斗美講師、名大 生命農学研究科 産業生命工学のMaturana Andres Daniel准教授らの共同研究チームによるもの。研究の詳細な内容は、日本時間5月24日付けで米国科学振興協会の科学誌「Science」に掲載された。
細胞内のカルシウムイオンは、筋肉の収縮の制御など、シグナル分子として非常に重要な役割を持っており、その濃度はさまざまなタンパク質により複雑に制御されている。CaCAファミリと呼ばれる一群の膜輸送体は、ナトリウムイオンや水素イオンなどの濃度勾配を利用してカルシウムイオンを細胞外へと輸送し、細胞内カルシウム濃度を一定に保つ仕組みを持つ。しかし、この膜輸送体がどのようにして2種類の陽イオンを逆向きに輸送するのか、詳細な分子機構はこれまでに明らかになっていなかった。
今回明らかになった結晶中のCAX_Afは、分子の中央に存在する水素イオンとカルシウムイオンの結合部位(H+/Ca2+結合ポケット)(画像1)が細胞内に向けて開いた状態を採っていた。画像1を用いて説明すると、分子の中央に水素イオンとカルシウムイオンの結合する部位(H+/Ca2+結合ポケット)が存在し、緑色の三角で示した細胞内側へとつながるイオン透過経路が存在するという形だ。
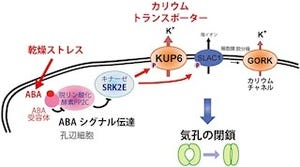
これはCaCAファミリの立体構造としては2012年になって初めて報告された、古細菌「Methanococcus jannaschii」由来の「ナトリウム-カルシウム交換輸送体(NCXMj)」の結晶構造とは反対側に開いた状態だった。NCXMjの結晶構造との比較から、TM1とTM6という2本の「αヘリックス」(タンパク質の構成要素であるアミノ酸が取りうる2次構造の1つ)が滑るように動くことで、CAX_Afの細胞の内と外側に向いた部分に、交互に親水性のくぼみを形成し、イオン透過経路を作り出すことが明らかになったのである(画像2)。研究グループは、この2本のαヘリックスを「ゲーティングバンドル」と命名。
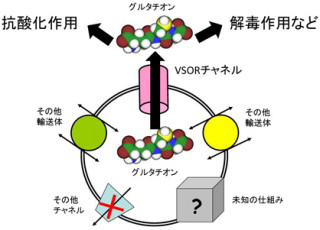
さらにCAX_Afの結晶構造において、カルシウムイオンの結合に関わる78番目と258番目のグルタミン酸の側鎖にはカルシウムイオンの代わりに水素イオンが結合し、周囲のアミノ酸との間に「水素結合」を形成していた(画像3)。この水素結合は、H+/Ca2+結合ポケットの周囲のαへリックスを安定化させていて、その結果、77番目と257番目のプロリンが疎水的なパッチ(疎水性な部分がつながった構造)を形成していたのである。
このような疎水性パッチはカルシウムイオンが結合していたNCXMjの結晶構造でも形成されており、ゲーティングバンドルが滑るように動いてイオン結合部位の開く方向を変えるために重要と、研究チームは推測。CAXAfにおいても、カルシウムイオン結合に関わるアミノ酸は完全に保存されているため、カルシウムイオンが結合することによっても、この疎水性パッチが形成されると予想されたのである。
一方、CAX_Afの結晶中では、258番目のグルタミン酸の水素イオンが外れた状態の構造も同時に観察された。水素イオンが外れた状態では、H+/Ca2+結合ポケットの中に見られた水素結合は壊れ、2つのプロリンの距離が離れて疎水性パッチは分断されていることが判明。
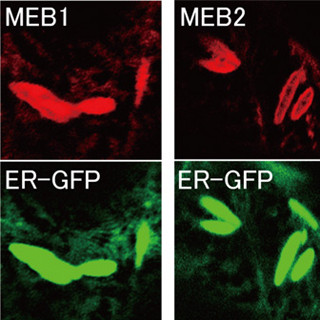
従って、CAXAfはイオンが結合していない状態では疎水性パッチが分断され、ゲーティングバンドルの構造変化が生じないようになっていることが判明した。これらの結果から、CAXAfは画像4に示されているように、相互に排他的に結合する水素イオンとカルシウムイオンの、いずれかが結合した状態では疎水性パッチが形成され、細胞内に開いた状態から細胞外に開いた状態へ、あるいはその逆の構造変化が可能になるという分子機構モデルが研究チームによって提唱された。
今回の結果は、細胞内カルシウム濃度の調節に重要な役割を持つCaCAファミリにおけるイオン輸送機構の一端を解明するものであり、今後、ヒトのCaCAファミリに対する阻害剤の開発など、筋疾患などに対する創薬開発につながることも期待されるとしている。