生理学研究所(NIPS)は4月24日、大脳基底核内部の神経回路の1つである線条体-淡蒼球投射経路が手や足の運動をストップさせる機能を担うことを、遺伝子改変マウスを用いた実験から実証したことを発表した
同成果はNIPSの佐野裕美 助教、南部篤 教授らの研究チームによるもの。詳細は米国神経科学会雑誌「The Journal of Neuroscience」に掲載された。
ハンチントン病やパーキンソン病といった難治性神経疾患で起きる手や足の「運動」の異常は、脳の大脳基底核と呼ばれる部分の異常により生じることが知られているが、今回、研究チームは、大脳基底核の線条体-淡蒼球投射経路だけをなくすことができる遺伝子改変マウスを用いてその働きの調査を行った。
従来の定説では、線条体-淡蒼球投射経路がなくなると、運動と関係のない自発的な大脳基底核からの出力信号(黒質網様部の活動)が減るとされていたが、今回の結果からは、そうした定説とは異なり、同経路が無くなっただけでは自発的な出力信号の変化は生じないことが確認された。

|
|
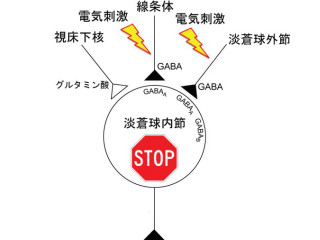
大脳皮質から「運動」の指令が出ると、その情報は大脳基底核の中でハイパー直接路、直接路、間接路という3つの経路を通り、出力部(黒質網様部)に伝えられ、運動が制御される。今回の遺伝子改変マウスでは、このうち、間接路の途中で線条体と淡蒼球をつなぐ、線条体-淡蒼球投射経路のみを選択的にイムノトキシンと呼ばれる毒素を使って無くした(上図の点線赤丸) |
また、大脳皮質を刺激して運動の指令を出したところ、正常であれば大脳基底核の出力信号に三相性(興奮-抑制-興奮)の反応が見られるはずのところ、三相目の遅い興奮が見られなくなることも確認された。これまでの研究から、線条体-淡蒼球投射経路が働かなくなると、手や足の運動を止めることができなくなることが知られていたが、これらの成果から、線条体-淡蒼球投射経路は大脳基底核出力信号の三相目の遅い興奮をもたらして手や足の運動を停止させる役割を持っており、働かなくなると手や足の運動を止めることができなくなることが示唆されたという。
この結果を受けて研究チームでは、難治性神経疾患であるハンチントン病の初期には、この線条体-淡蒼球投射経路が侵されることから、今回のマウスは初期のハンチントン病のモデル動物と考えることができ、この成果を活用することで、ハンチントン病の病態生理の解明や治療法の開発につながることが期待されるとコメントするほか、大脳基底核はパーキンソン病とも深く関わる領域であり、パーキンソン病の場合、今回の実験で明らかとなった運動を停止させる機能が逆に亢進し、動きづらくなってしまっていると考えられることから、同経路を働かなくすることができれば、パーキンソン病の治療法や病態生理の解明にもつながることが期待されるとしている。