千葉大学、科学技術振興機構(JST)、理化学研究所(理研)、京都大学の4者は1月14日、分子モーターである「V型ATPase(V型アデノシン三リン酸フォスファターゼ、V型ATPアーゼ)」の回転部分の詳細構造を解明し、ATPのエネルギーが回転運動に変換される仕組みの大枠が原子レベルで明らかにしたと共同で発表した。
成果は、千葉大大学院 理学研究科の村田武士特任准教授(JSTさきがけ研究者、理化学研究所 客員研究員)らの研究グループによるもの。研究の詳細な内容は、英国時間1月13日付けで英国科学雑誌「Nature」のオンライン速報版に掲載された。
V型ATPaseは、細菌からヒトまで多くの生体膜中に存在し、体内のエネルギーの通貨といわれる「ATP(アデノシン三リン酸)」のエネルギーを使って水素イオンを運ぶことで、膜内外のpHを調整している。
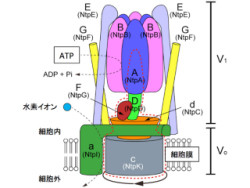
V型ATPaseは骨の形成に関わる「破骨細胞」やがん細胞の細胞膜にも存在しており、骨粗鬆症やがん細胞の増殖・転移に関与していることがすでに知られている。そのため、V型ATPaseの分子メカニズムを知ることは、これら疾病の理解に繋がり、V型ATPaseの阻害剤は治療薬として期待されている。そしてV型ATPaseは、親水性の「V1部分」と膜内在性の「Vo部分」という構成の仕組みだ(画像1)。
画像1はV型ATPaseの構造モデル(カッコ内の名称は「腸球菌V-ATPaseサブユニット」の旧名)。V型ATPaseは9~13種類のタンパク質からなる超分子複合体で、水溶性タンパク質部分(V1部分)と膜タンパク質部分(Vo部分)からなる。触媒頭部(A3B3)でATPを加水分解し、回転軸(DFd)とローターリング(c)を回転させ、水素イオンを細胞外(またはオルガネラ内)へ輸送する。
V型ATPaseは触媒頭部(A3B3複合体)でATPを加水分解し、そのエネルギーを使って軸部分を回転させ、これに伴ってVo部分で水素イオンが輸送されると考えられている。しかし、詳細構造が不明であったため詳しい仕組みは未解明だった。
研究グループは今回の研究で、細菌(腸球菌)にもヒトV型ATPaseによく似た酵素が存在することを発見し、その生化学的・構造生物学的研究を進めた。また最近では、ヒトと腸球菌のV型ATPaseの回転軸「DF複合体」の詳細構造をそれぞれ解明している。得られた構造は互いにそっくりで、V型ATPaseの動作原理はヒトと腸球菌で酷似していることが明らかとなった。
今回は、V型ATPaseがATPの化学エネルギーを物理的な回転エネルギーに変換する仕組みを明らかにすることを目的に、腸球菌V型ATPaseの触媒部分およびV1複合体のX線結晶構造解析が試みられたのである。
当初は大腸菌を用いてAとBサブユニットをそれぞれ精製後、A3B3複合体を再構成していたが、大量調製が難しく、良質の結晶を得ることができなかった。そこで、「大腸菌無細胞タンパク質合成系」を用いてAとBサブユニットの共発現精製系を検討し、A3B3複合体を大量精製に成功した形だ。
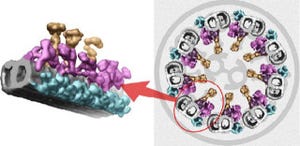
この高純度な標品を用いることにより、ATPなどのヌクレオチドは入れない条件で良質の結晶を得ることができ、そのX線結晶構造(分解能2.8Å)を明らかにした(画像2)。
得られた複合体リング構造は、同じ3つのAサブユニット、Bサブユニットから構成されているのにも関わらず完全に非対称であり、それぞれのサブユニットはすべて異なる立体構造を形成していたのである(画像3)。
次に、ATPに似た構造を持つ非分解性の類似体「AMP-PNP」存在下で、A3B3複合体のX線結晶構造(分解能3.4Å)を明らかにした。A-B境界面に存在する計3ヵ所のATP結合部位の内、2カ所にAMP-PNPが結合し、これにより一部のA3B3複合体の立体構造が変化していることが判明(画像4・5)。
得られた2つのA3B3複合体の構造を比較することにより、A3B3複合体は「ATPが結合できないフォーム:Empty」、「ATPを結合することができるフォーム:Bindable」、「ATPを結合しているフォーム:Bound」の3つの異なるA-B複合体から構成されていることが明らかになった(画像3)。
ATP存在下では、BindableフォームにATPが結合し、2つのBoundフォームができる(画像5)。元々あったBoundフォームのATPが分解されると、A3B3複合体は初めの構造に戻るように変化すると考えられた。つまりA3B3複合体の構造を120°回転させた構造に変化することになる。
以上の考察から、なぜ分子モーターがATPのエネルギーを使って一方向に回転するかの仕組みを立体構造から理解することができたというわけだ。

|

|
|
触媒部分(A3B3複合体)のX線結晶構造。画像2(左)は横から見たA3B3複合体の結晶構造。画像3は上から見たA3B3複合体の結晶構造。見やすくするため、「N末βバレルドメイン」と「C末ドメインのみを表示している」。3カ所ある赤い矢頭は、ATP結合部位を示したもの |
|
次に、A3B3複合体とDF複合体からV1-ATPase(A3B3DF複合体)の再構成条件を「SPR(表面プラズモン共鳴)法」を用いて検討した。酸性pHやマグネシウム存在下でV1-ATPaseを安定に精製することができ、この標品を用いることでV1-ATPaseの高分解能X線結晶構造(2.2Å)を得ることに成功したのである(画像6)。
上記のA3B3複合体と構造を比較することにより、DF複合体結合によるA3B3複合体の構造変化を理解することが可能だ。その結果、DF複合体が結合することにより、「ATPを結合することができるフォーム:Bindable」はATPが結合していないのに「ATPを結合しているフォーム:Bound」に変化し、「ATPを結合しているフォーム:Bound」はA3B3複合体には存在しなかった「よりコンパクトなフォーム:Tight」に変化していた(画像7)。

|

|
|
V1-ATPase(A3B3DF複合体)のX線結晶構造。画像6(左)は横から見たV1-ATPaseの結晶構造。画像7。は上から見たV1-ATPaseの結晶構造。見やすくするためにN末βバレルドメインとC末ドメイン、Dサブユニットのみを表示している。赤い矢頭は、3カ所あるATP結合部位を示したもの |
|
さらに、AMP-PNPが2つ結合したV1-ATPaseのX線結晶構造(2.7Å)も解明。これらの構造を比較することにより、結合したATPは「よりコンパクトなフォーム:Tight」で加水分解が誘導されることが示唆された。
つまり、DF複合体は単にA3B3複合体の構造変化に応じて回転しているのではなく、A3B3複合体と結合して構造を変化させて、ATPの分解場所を決定していることが示唆されたのである。以上の発見を基にまったく新規なV1-ATPaseの回転メカニズムモデルが提案されたというわけだ。
今回の研究により、A3B3複合体の役割、DF複合体の役割、なぜ一方向に回転するかの理由、ATPがどこで分解されるかなど、多くの情報を理解することができるようになったという。
これにより、そのほかの分子モーターを含む生体エネルギー変換機構の一般原理の解明に繋がることが期待されるとした。また、V1-ATPaseの詳細な分子メカニズムが解明されることで、関連する骨粗鬆症やがん転移などの疾病原因の理解やその治療薬の開発についても進展することが期待されるとも、研究グループはコメントしている。