大阪大学(阪大)は、細菌遺伝子分配の仕組みを低温電子顕微鏡法と一分子イメージングを活用することにより解明したと発表した。
同成果は同大大学院生命機能研究科の藤井高志研究員(現 理化学研究所)、難波啓一 教授と英国ケンブリッジMedical Research Council分子生物学研究所のJan Lowe氏らの共同研究グループによるもので、詳細は米国科学誌「Science」電子版に公開された。
大腸菌などの細菌は細胞分裂時に、遺伝情報を格納した「プラスミド」と呼ばれるDNA分子を娘細胞に均等に分配する機構を備えている。多数存在するプラスミドは細胞が中央で分裂することにより約半数ずつに分配されるが、小数(4~6個)しか存在しないプラスミドは細胞全体に均等に分布していないため娘細胞に分配できない可能性が考えられるが、ParM, ParR, parCと呼ばれる3種類の分子によって精巧な分配が実現されている。
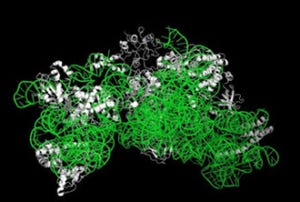
今回の研究ではこのプラスミドの均等分配の仕組みを、ParM繊維の低温電子顕微鏡による構造解析と、ParM/ParR/parC複合体の一分子光学計測による動態観察により解明を行った。
ParMは筋細胞のアクチンと似たタンパク質で、らせん状に重合して繊維を形成している。また、ParRはこのParM繊維の先端に結合し、プラスミドを繊維の端に結合するアダプターの役割を担うとともに、ParMの重合を助けて繊維形成を4倍加速させる。そしてparCは運ばれるプラスミドの部分配列で、これまでは、一本のParM繊維の両端にParRとparCが結合し、繊維が両端方向に伸長することで一対のプラスミドを細胞両端に移動させるものと信じられてきた。
しかし、今回の研究により、2本のParM繊維が逆平行にバンドルを形成し、それぞれの片端にのみ結合したParRにより繊維が一方向に伸長しつつ、伸びるたびに逆平行スライディングを起こすことでバンドルが伸び、その両端に結合したプラスミドを細胞両端に送り届けることが明らかとなった。研究グループによると、この逆平行バンドル化とスライディングがプラスミド均等分配の肝であり、これまでの定説が覆されたとする。
さらに1分子光学計測によりParM繊維の逆平行バンドル化とスライディングが頻繁に起こっていることも観察したほか、低温電子顕微鏡法による高分解能構造解析によりParM繊維の構造を明らかにし、2本の繊維からなる逆平行バンドルの原子モデルを構築し、繊維間相互作用に関わるParMのアミノ酸を同定。このアミノ酸を変異させたところ、2本の繊維のスライディングが停止することが確認された。これにより、機能的アミノ酸が繊維表面に存在して繊維間の自発スライディングを引き起こし、それによって逆平行バンドル化が自然と生じるらしいことが判明。この結果、一対のプラスミドのそれぞれを細胞両端に向かって運搬し引き離す仕組みが明らかになったとする。
プラスミドの均等分配機構は、細胞が分裂し子々孫々まで遺伝子を伝え増殖するために必須なものであり、研究グループでは、今回の成果により、遺伝子分配機構の本質に一歩近づいたとしている。