慶應義塾大学(慶応大)は9月25日、東京慈恵会医科大学(慈恵医科大)、大阪バイオサイエンス研究所の協力を得て、慢性腎臓病の進行過程で認められる腎臓の線維化において、生理活性物質「プロスタグランジンD2(PGD2)」が果たす役割を明らかにし、その受容体である「CRTH2受容体」を阻害することで腎臓の線維化の進行を抑制し得ることを、マウスの実験において明らかにしたと発表した。
成果は、慶応大 医学部循環器内科の佐野元昭専任講師、同・福田恵一教授、慈恵会医科大 腎臓・高血圧内科の伊藤秀之助教、同・宇都宮保典准教授、同・細谷龍男教授、大阪バイオサイエンス研究所 分子行動学部門の永田奈々恵研究員、同・有竹浩介研究員、同・裏出良博教授らの研究グループによるもの。研究の詳細な内容は、9月20日付けで米国腎臓病学会雑誌「Journal of the American Society of Nephrology」に掲載された。
日本における血液透析治療を要する慢性腎臓病患者は、2008年に30万人を突破してからも増加の一途をたどっており、透析治療にかかる国が負担する医療費は年間1兆数千億円を超えるとされている。
慢性腎臓病が進行すると。最終的には血液透析をはじめとする腎代替療法が必要となるので、その進行スピードをできるだけ遅くするために一部の降圧剤などが使用されているが、十分な治療効果を発揮しているとはいえない。
糖尿病や高血圧など、さまざまな病気によって引き起こされる慢性腎臓病の進行過程において共通して不可逆的な腎臓の線維化が認められ、線維化の程度は腎機能予後(腎臓の機能がどれくらい保たれるか)を反映することが知られている。
この腎臓の線維化を抑制する薬剤として、近年「ピルフェニドン」が注目されているが、腎臓の分野ではまだ十分なエビデンス(医学的根拠)が得られておらず、新規の線維化を制御する薬剤の開発が望まれている状況だ。
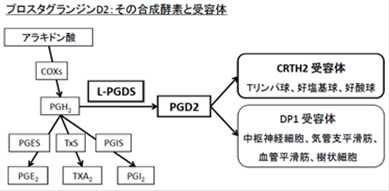
これまでに、糖尿病あるいは高血圧患者において「リポカリン型プロスタグランジンD2合成酵素(L-PGDS)」(画像1)の尿中への排泄が増加していることが知られており、さらに裏出良博教授らは2009年に、L-PGDSが「腎尿細管上皮細胞」に発現していることをサルにおいて報告を行っている。しかし、L-PGDSあるいはその合成産物であるPGD2が、腎臓においてどのような役割を果たしているのかは不明だった。
今回、伊藤助教、佐野専任講師らはL-PGDSのノックアウトマウスに、人為的に腎臓の線維化を誘導するための「片側尿管結さつ術(UUO)」(画像2)を施すことにより、腎臓内のPGD2系が腎臓の線維化に対してどのような役割を果たしているのかを検討。さらに、PGD2の受容体であるCRTH2のノックアウトマウス、CRTH2の経口阻害薬「CAY10471」を投与したマウスを用いて、同様の実験を行った。
その結果、野生型のマウスに対して、L-PGDSノックアウトマウス、CRTH2ノックアウトマウス、CRTH2阻害剤投与マウスでは、片側尿管結さつ術に伴う腎臓の線維化が顕著に抑制されることが見出されたのである。
|

|
|
画像1。PGD2の合成酵素と受容体。リポカリン型プロスタグランジンD合成酵素によって作られたPGD2は、2つの受容体「DP1」と「CTTH2」を介してさまざまな生理活性作用を発揮する |
画像2。UUO。マウスの片側の尿管を結さつすることによって腎線維化を誘導する実験手技だ |
まず、野生型マウスにUUOを施すことにより、腎尿細管上皮細胞でL-PGDSの発現がタンパク質レベル、遺伝子レベルで増加することが確認された。次に、UOO施行10日目における腎臓の線維化が調べられたところ、野生型マウスに対してL-PGDSノックアウトマウスでは線維化の進行が顕著に抑制されていることが確認されたのである。
この時、腎臓に対してどのような「炎症細胞」が浸潤(周囲にしみるように広がる様子)しているのかが調べられた結果、L-PGDSノックアウトマウスでは野生型に比べて2型ヘルパーT細胞(Th2)の浸潤が顕著に抑制されていた(1型ヘルパーT細胞(Th1)に関しては違いがなかった)。
CRTH2受容体はTh2に発現し、これを活性化する機能を持つことが知られている。このことから伊藤助教、佐野専任講師らは、腎臓内で合成されたPGD2は局所におけるTh2の活性化を誘導し、そのTh2が産生する「サイトカイン」である「インターロイキン-4(IL-4)」あるいは「インターロイキン-13(IL-13)」が増加することで腎臓の線維化が進んでしまうのではないかという仮説を立てた。
次に、CRTH2ノックアウトマウスにおいても同様の実験を実施。すると、やはり野生型に比べて腎臓の線維化は抑制され、Th2の浸潤、IL-4/IL-13の発現は顕著に抑制されていたのである。
さらにCRTH2の経口阻害薬であるCAY10471を、UOO前、UOO実施から3日後、同5日後と、投与開始時期を変えて野生型マウスに投与したところ、UOO前あるいはUOO3日後に投与を開始したグループでは腎臓の線維化抑制効果が得られたが、UOO5日後に投与を開始したグループでは十分な効果が得られなかった。これは、CAY10471を疾患発症の早期から投与することで腎臓の線維化を抑制する効果が期待できることを示唆している(画像3)。
画像3は、CRTH2受容体拮抗薬によって腎臓の線維化が抑制される様子を表した模式図。高血圧、糖尿病などによって腎臓にストレスが加わると、腎臓の尿細管においてPGD2合成酵素であるL-PGD2の発現が誘導され、PGD2が産生される。PGD2は、腎臓の間質に存在する線維芽細胞にCRTH2受容体を介して作用し、コラーゲンの産生を促し、腎線維化を促進することが発見された。
動物実験においてCRTH2受容体拮抗薬が、腎線維化を抑制したことから、喘息の治療薬としてすでに臨床で使用され、さらに多くの化合物が臨床治験中であるCRTH2受容体拮抗薬は、喘息の治療薬としてだけではなく、腎線維化を抑制して、慢性腎臓病の進行を遅延させる新しい治療薬としての可能性も秘めていると考えられるという。
これらの結果から、腎臓の線維化を抑制する新たな治療法として、腎臓局所におけるPGD2-CRTH2系の制御が大きな可能性を秘めていることが示唆された。さらに今回の研究を進めることにより、糖尿病をはじめとする慢性腎臓病の、PGD2-CRTH2を標的とした新たな薬剤の開発が期待されると、研究グループはコメントしている。
今日、臨床で使用されているCRTH2阻害薬「ラマトロバン」は、CRTH2受容体以外の受容体に対する阻害効果も有している。そのため、研究グループでは現在、より選択的に、より強力にCRTH2受容体を阻害できる薬剤を用いて、糖尿病性腎症をはじめとした慢性腎臓病疾患モデルマウスに対する治療効果を検討中だ。これらの薬剤は、少なくとも動物実験レベルにおいて重篤な有害事象は報告されておらず、今後の臨床試験への応用が期待されているという。
糖尿病はもちろん、高血圧や慢性糸球体腎炎などの慢性疾患の患者にできるだけ疾患発症の早期から投与を開始することで、慢性腎臓病の進展、ひいては血液透析をはじめとする腎代替療法への移行を阻止または遅らせることができれば、患者のQOL(Quality of Life:人生の質)を改善することができるばかりでなく、年々逼迫している医療経済に対しても大きなメリットとなることが期待されていると、研究グループはコメントししている。