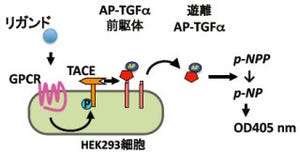
東京大学は9月24日、新エネルギー・産業技術総合開発機構(NEDO)の創薬加速支援事業の一環として、核磁気共鳴装置(NMR)を用いて薬の効き具合を正確に予測する手法を開発したことを発表した。
膜タンパク質のNMRシグナル変位を観測することによって薬効を予測するもので、無数の物質から薬の候補物質を見つけ出す際の動物実験などで調べる従来の方法と比べ、薬の候補物質探索を大幅に効率化することができるようになる。
成果は、東大大学院 薬学系研究科の嶋田一夫教授らの研究グループによるもの。研究の詳細な内容は、9月4日付けで英国科学誌「Nature Communications」に掲載された。
ヒトをはじめ多くの生命体の細胞膜上には、細胞外からのシグナルを細胞内に伝える役割を持つ「受容体」と呼ばれる膜タンパク質が多数存在し、外部環境を感知して細胞内に伝え、さまざまな生命活動を維持している。
中でも「Gタンパク質共役型受容体(GPCR)」と呼ばれる膜タンパク質にはシグナルごとに多種多様なものが存在し、生活習慣病や精神疾患からがんなどのさまざまな疾病に関与していることが多いため、GPCRは医薬品開発における主要な標的となっている具合だ。
これまでにも、このGPCRの機能を高めたり阻害したりする物質が探索されて医薬品が作られてきたが、同一のGPCRに結合する医薬品であっても、その効果の程度に差があったり、まったく逆の作用を示すものがあり、なぜこのような現象が起きるのか、その機構は不明のままだった(画像1)。
したがって、これまでのGPCRを標的とした医薬品探索においては、カギとカギ穴のような関係でGPCRに結合する物質を探索することから始まり(スクリーニング)、その後は研究者の経験と勘に頼る形で目的の効果を持つ化合物に修飾していくため、その成功確率は低く、医薬品候補物質を見出すまでには多大な時間と労力を要していた。
そうした状況において嶋田教授らは今回、NMRを用いた解析手法を開発して、「リガンド(受容体結合分子)」によるGPCRの機能調節の仕組みを突き止めることに成功。
GPCRの立体構造には「活性型」と「不活性型」が存在し、生体内ではそれらの立体構造が共存して、互いに行き来する「動的平衡状態」にあることが明らかになった。
さらにリガンドがGPCRに結合すると、この活性型と不活性型の存在比率に偏りが生じ、その結果としてGPCRの機能が調節されることも確認されたのである。この活性型と不活性型の存在比率の偏りの度合いが、結合したリガンドの種類によって異なるため、これがリガンドごとに効果が異なる要因であることも明らかになった。
今回開発されたNMR解析手法を医薬品開発の初期段階に導入することにより、研究者の経験と勘に頼らず、さらには細胞実験もしくは動物実験を必要とせずに、リガンドとなる医薬品候補化合物の効果を予測することが可能になるため、医薬品開発が加速されることが期待されるという。
GPCRのことをもう少し詳しく説明すると、7回膜貫通構造を有する膜タンパク質ファミリの1つであり、リガンドの結合によってGタンパク質を介したシグナルを惹起して細胞内に伝達するが、シグナル伝達の強度はリガンドによって異なることが知られている。この現象は、ほかの受容体では見られないGPCRの機能的特徴だ。
リガンドとなる医薬品は、その作用の程度により、「full agonist(完全作動薬)」、「partial agonist(部分作動薬)」、「neutral antagonist(阻害剤)」、「inverse agonist(逆作動薬)」に分類され、これらは病態により使い分けられている。
例えば、「β2-アドレナリン」受容体に対する医薬品の場合、full agonistは急性期の喘息に対して有効だが、長期間にわたる治療ではpartial agonistを用いた方がよいともいわれており、状況によって変わってくるというわけだ。従って、医薬品による受容体の機能調節の仕組みを理解することは、医薬品開発において重要になってきる。
前述したように、これまでにさまざまなリガンドに結合したGPCRの結晶構造が明らかになっているにも関わらず、リガンドごとに作用の強度が異なる機構は明らかではなかった。
そこで今回の研究では、溶液中のタンパク質の立体構造情報を取得可能なNMRを用いて、β2-アドレナリン受容体を解析対象とし、そのシグナル調節機構を明らかにした次第だ。
昆虫細胞を用いて、安定同位体標識「メチオニン」を導入したβ2-アドレナリン受容体を調製し、full agonistおよびinverse agonistを添加してNMRスペクトルが測定された。その結果、膜貫通領域に存在する82番のメチオニン由来のNMRシグナルは、GPCRの活性型および2種類の不活性型を反映することが判明したのである。
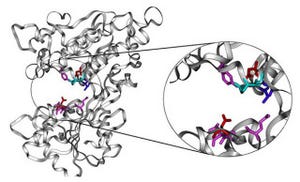
さらに、neutral antagonistおよび2種類のpartial agonistの結合状態について、シグナルの変化を解析したところ、作用の強度依存的に、活性型と不活性型との中間の位置にシグナルが観測された(画像2)。
その上での温度変化実験およびシミュレーションなどの結果を考えあわせた結果、(1)β2-アドレナリン受容体の立体構造は、活性型と2種類の不活性型の間の動的平衡状態にある。(2)リガンドごとの作用強度の違いは、平衡状態での活性型の存在比率の違いに起因する、と結論づけられた(画像3)。
GPCRにおいて、膜貫通領域でのシグナル伝達に関わる構造変化様式は共通しているため、今回の研究の成果は、多くのGPCRのシグナル制御機構を解明する上で普遍的な知見を与えるものといえると、嶋田教授らはコメント。
また医薬品開発研究においては、従来の受容体とリガンドの結合の親和性を上げる戦略とは一線を画し、動的平衡をシフトさせてリガンドの「質」を変える新しい概念につながるとも述べている。