東北大学、東京大学、愛媛大学、科学技術振興機構の4者は、薬の大半が効果を発揮するために作用する「Gタンパク質共役型受容体(GPCR)」の活性化を検出する新規手法を共同で開発し、116種のGPCRとそのリガンド(特定の結合分子)の組み合わせの内、世界最高級の値となる約90%の104種類の活性化を測定可能としたことを共同で発表した。また、同手法を用いて、生理活性脂質「リゾホスファチジルセリン」に対する3種類の受容体「P2Y10」、「GPR174」、「A630033H20」の発見に成功したことも併せて発表している。
成果は、東北大大学院 薬学研究科の青木淳賢教授、同・井上飛鳥助手、同・巻出久美子助教、東大大学院 薬学系研究科の新井洋由教授、同・大和田智彦教授、愛媛大 プロテオ医学研究センターの東山繁樹教授らの研究グループによるもの。研究の詳細な内容は、米国学術雑誌「Nature Methods」10月号に掲載される予定だ。
細胞は、外界との情報の受け渡しをさまざまな分子を介して行う仕組みを持つ。細胞外からの情報を受け取るタンパク質は「受容体」と呼ばれ、その中でもGPCRの一群が最も重要な役割を担う。
GPCRは全タンパク質の中でも最大の遺伝子ファミリーを形成しており、実際にヒトゲノム中には800種類以上ものGPCRが存在している。GPCRは細胞膜上に存在し、細胞外から運ばれてくるホルモンや成長因子などと結合し、細胞内へ信号(シグナル)を伝えている仕組みだ。
また、GPCRの機能の異常は多くの疾患を引き起こすことがわかっている。病態時のGPCRの機能異常を正すことは、病気の治療につながるというわけだ。実際、GPCRを標的とした薬は数多く開発されて成功しており、現在市販されている薬の半数近くになる。
したがって、GPCRの機能を理解することは、創薬開発の近道であるといえよう。GPCRの役割は細胞外のリガンドの量を感知して、細胞内へシグナルを伝えることだ。GPCRはリガンドと結合すると構造変化(活性化)を起こし、細胞内タンパク質「三量体Gタンパク質」を呼び寄せ、さまざまな下流のシグナルを誘導する仕組みを持つ。
そして三量体Gタンパク質は、「Gs」、「Gi」、「Gq」、「G12/13」の4種類に大別され、それぞれの下流では、「サイクリックAMP」濃度の変動(Gs、Gi)、細胞内カルシウム濃度の変動(Gq)、低分子量Gタンパク質「Rho」への「GTP結合」(G12/13)が起こる。このような細胞内イベントを検出することで、GPCRの活性化を測定することが可能だ。
しかし、GPCRは通常1~2種類の三量体Gタンパク質としか結合(「共役」とも呼ばれる)しないことから、特定の細胞内イベントを観察するだけでは、多くても半数程度のGPCRの活性化しか検出することができない。
そこで、多くのGPCRの活性化を同一の方法で検出できるような新規GPCR活性化測定法が期待されていた。特に、G12/13の下流での細胞内シグナルを定量的に検出する手法の開発は遅れており、G12/13と結合するGPCRの機能を解明する上で大きな障害となっていたのである。
青木教授と井上助手は以前の研究成果として、毛の成長に生理活性脂質「リゾホスファチジン酸」とその受容体でGPCRの1種である「LPA6」が必須の役割を果たしていることを見出していた。そこで今回、LPA6の下流の分子機構を詳細に調べたところ、毛根の上皮細胞において膜型タンパク質分解酵素「TACE」が活性化し、「トランスフォーミンング増殖因子α(TGFα)」の「膜結合前駆体」を切断し、細胞外へ放出するという現象が確認されたのである。そして、この「LPA6-TACE-TGFα」の経路が、正常な毛根の成長に必須であることが発見されたというわけだ。
この研究過程から、研究グループはTACEによるTGFαの切断という現象を培養細胞中で再現することで、ある種のGPCRの活性化が検出可能になるのではないかと想定したのである。
研究グループは上述の背景を受け、TACEによるTGFαの切断がGPCRの下流で普遍的に起こる現象かどうか検討した。まず、リガンドがすでに知られている116種類のGPCRとそのリガンドの組み合わせで検討。
ヒト腎臓由来の細胞株である「HEK293細胞」にGPCRをコードする遺伝子と、東山教授が確立した「アルカリホスファターゼ(AP)融合TGFα(AP-TGFα)」をコードする遺伝子を「リポフェクション法」で導入し、この細胞をそれぞれのGPCRのリガンドで刺激した後に、細胞外へのAP-TGFαの放出量の評価が行われた。
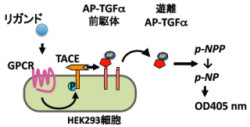
その結果、実に7割ものGPCRの活性化が今回の「TGFα切断アッセイ法」(画像1)で検出できることがわかったのである。また、TGFα切断を引き起こしたGPCRの特徴を調べると、GqまたはG12/13と共役するGPCRであることがわかった。
|
|
画像1。新規GPCR活性化検出法(TGFα切断アッセイ法の原理)。同法では、HEK293細胞にGPCR、AP標識TGFα前駆体(+キメラGタンパク質)を発現させ、リガンド刺激後1時間中に細胞外に遊離したTGFα量をAP活性を指標に検出する |
そこで、GsやGiのシグナルをそれぞれGqやG12/13のシグナルに変換することのできる「キメラGタンパク質」を導入したところ、116種類のGPCRの内104種類のGPCRの活性化を検出することに成功したのである。
このようにTGFα切断アッセイは90%以上のGPCRについて活性化を検出し、この割合は既存の手法を大きく超えることから、その有用性が示された形だ。また、TGFα切断アッセイ法は作動薬や遮断薬の反応を検出できるだけでなく、創薬に最も有効であると考えられている逆作動薬の検出にも有効だったのである。
続いてTGFα切断アッセイ法を用いて、リガンド未知の「オーファンGPCR」のリガンド探索が行われた。その結果、3つのGPCR(P2Y10、GPR174、A630033H20)が生理活性脂質のリゾホスファチジルセリンに応答することが発見された(画像2)。

|
|
画像2。同定された新規リゾホスファチジルセリン受容体。TGFα切断アッセイ法を用い、リゾホスファチジルセリン応答性GPCRを探索し、P2Y10、GPR174、A630033H20の3つの新規GPCRを同定し、それぞれLPS2、LPS2L、LPS3と命名された |
これらの受容体はいずれもG12/13に共役すること、リゾホスファチジルセリンの構造類似体(大和田教授、新井教授により有機合成)の反応性からリゾホスファチジルセリンの構造を厳密に認識する受容体であることが判明。
リゾホスファチジルセリンは、リンパ球の増殖抑制やマスト細胞の活性化などの作用が知られており、これら3つのGPCRの研究を通じて生体内の新たな生理活性物質の解明が進むことが期待される。
これまで、G12/13と共役するGPCRは活性化の検出が困難であり、作動薬、遮断薬の開発が遅れていた。今回の研究で開発されたTGFα切断アッセイを用いることで、これまで困難であったG12/13と共役するGPCRに対する創薬が一気に加速化されるものと期待されるという。
また、TGFα切断アッセイ法はオーファンGPCRのリガンド同定や、リガンドの作用様式の評価にも極めて有効である点でも、新規創薬への貢献が期待されている。さらに、今回、リゾホスファチジルセリンに反応するGPCRを複数発見したことで、未解明な点が多く残るこの生理活性脂質の研究が加速することが期待されるとも研究グループはコメントしている。