京都大学は9月14日、人工酵素「ジンクフィンガーヌクレアーゼ(ZFN)」を利用することで、「重症免疫不全(SCID)ラット」を作製することに成功したと発表した。
成果は、京大 医学研究科 附属動物実験施設の真下知士 特定准教授を中心とした、同・放射線生物研究センター、同・iPS細胞研究所、京大アステラス創薬プロジェクト(AKプロジェクト)、フェニックスバイオ、広島大学肝臓プロジェクト研究センターとの共同研究グループによるもの。研究の詳細な内容は、9月13日付けで米国科学誌「Cell Reports」オンライン版に掲載された。
SCIDマウスは、「DNA.依存性プロテインキナーゼ(Prkdc)」遺伝子の変異により、「機能的T細胞」および「B細胞」を欠くことで、重度の免疫不全を呈する。そのため、異種細胞・組織の移植に対する拒絶反応が少なく、ヒト正常細胞の異種移植が可能となり、腫瘍医学、免疫学、臓器移植などの分野で広く利用されているモデルマウスだ。
また、SCIDマウスにはNK活性が残っていることから、それを取り除き細胞の生着率を向上させるために、「I型糖尿病NODマウス」と交配させた「NOD-scidマウス」、NOD-scidマウスと「IL-2受容体ガンマ鎖(Il2rg)ノックアウトマウス」を交配させた重症免疫不全の「NOGマウス」や「NSGマウス」などが開発されている。
一方、実験用ラットは、ヒト疾患モデルとしての利用価値が高く、薬理薬効試験、毒性試験などに多用されている。近年、人工酵素ZFNにより、これまで遺伝子改変技術がなかったラットにおいて、遺伝子改変を行うことが可能となった。今回の研究では、ZFN技術を利用して重症免疫不全のラットの開発が行われた次第だ。
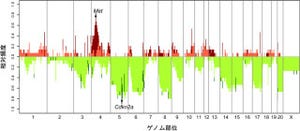
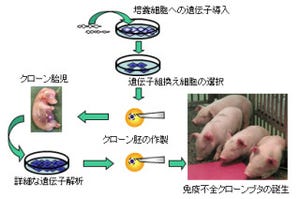
Prkdc遺伝子の第1エクソンを標的とするZFN(メッセンジャーRNA)を「F344ラット受精卵」の雄性前核に導入することで、Prkdc遺伝子を欠損したSCIDラットを作製することに成功した(画像1・2)。
SCIDラットの特徴だが、対照F344ラットと比べて、体重の減少、「線維芽細胞(REF)」の増殖能力低下、老化特性などを示した。これまでSCIDマウスにはこのような特性は報告されておらず、マウスとラットの種差をあらわしていると考えられる。
さらに、SCIDラット由来のREF細胞は、放射線照射に対する高感受性を示し、放射線誘発二本鎖切断に対して、DNA修復能の低下を示した。このDNA修復能の低下は、非相同末端結合(NHEJ)機構の欠損によるものと考えられた。
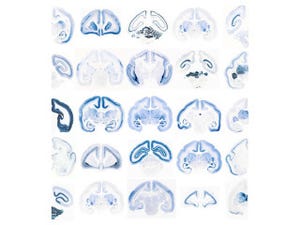
また、SCIDラットには胸腺の著しい萎縮、T細胞、B細胞の欠落が認められた(画像3)。SCIDマウスでは、一部の個体、あるいは加齢と共に血中「IgG」などの「免疫グロブリン」が検出される「Leaky(漏出)」と呼ばれる現象が知られているが、SCIDラットではすべての個体においてLeaky現象は認められなかった。
これらマウスとラット間における明らかな特性の違いは、Prkdc遺伝子の生物種間における機能の差によるものと考えられた。
さらに、Prkdc遺伝子を標的としたZFNと、Il2rg遺伝子標的としたZFNの2つのZFNsを使うことで、Prkdc遺伝子(SCID)とIl2rg遺伝子(XSCID)両方を同時に欠損したFSG(F344-scid Il2rg)ラットを作製することに成功したk形だ。
このFSGラットは、SCIDラットのさまざまな特性に加えて、胸腺、脾臓などの一次リンパ組織のさらなる萎縮や、T細胞、B細胞に加えて「NK細胞」の欠損が確認された(画像3)。
ヒト細胞移植モデルとしてSCID、FSGラットを評価するため、ヒトiPS細胞「201B7」をラットの精巣に移植した。約6~8週間後に免疫不全ラットの全個体において、精巣内に「テラトーマ(奇形腫)」と呼ばれる内胚葉、中胚葉、外胚葉由来の多種類の分化した細胞を形成させることに成功した(画像4左)。
さらに、ヒト卵巣がん細胞株(A2780)をSCID、FSGラットの皮下に移植したところ、免疫不全ラットのすべての個体で、ヒト腫瘍細胞が増殖した。FSGラットにおいて、SCIDラットよりもヒト卵巣がん細胞のはやい増殖が認められたことは、おそらくFSGラットのNK細胞欠失によるものと考えられる(画像4中)。
最後に、このFSGラットを利用して肝ヒト化ラットの作製を試みた。肝細胞の増殖を阻害するアルカロイドの一種であるレトロルシンでFSGラットを処置した後に、門脈経由でヒト肝細胞を移植した。移植後からすぐにヒトアルブミンがラット血中に持続的に検出された。ヒト肝細胞移植6週後にFSGラットの肝臓が調べられた結果、ヒト肝細胞の生着および増殖が確認された(画像4右)。

|
|
画像4。(左)免疫不全ラット精巣内におけるヒトiPS細胞のテラトーマ形成。(中)SCID、FSGラット皮下移植によるヒト卵巣がん細胞の担がん試験。(右)肝ヒト化ラットの血中に検出されたヒトアルブミンと、ラット肝臓内に定着・増殖したヒト肝細胞 |
今回、ZFN技術により新たに作製された免疫不全SCIDラット(Prkdcノックアウトラット)において、これまでSCIDマウスで報告されていた特性とは異なる点がいくつか発見された。
SCIDラットでは、体重減少、線維芽細胞の増殖能力低下、老化特性、leaky現象の欠落、より重度の免疫不全症などが確認され、これらの特性はヒトにより近いと考えられている。
このことは、Prkdc遺伝子発現量の生物種間における「違い」により一部が説明され、放射線照射などによるDNA損傷に対する修復機構において、生物種による違いが存在すると考えられるという。
今後、ZFN技術などの遺伝子改変技術により、さまざまなノックアウトラットを作製して、マウス、ラット、ヒトの病態特性を比較することで、このような生物種による違いが明らかになっていくことが推察されると、研究グループは述べている。
また今回の研究では、重症免疫不全SCIDラット、FSGラット(SCID、XSCIDダブルノックアウト)に、ヒトiPS細胞、ヒトがん細胞、ヒト肝細胞を移植することで、ラット体内でこれらヒト細胞を長期培養、増殖させることに成功した。
このように、拒絶反応の弱い免疫不全動物にヒト細胞や組織を移植した動物のことを「ヒト化動物」という。ヒト化動物は、動物体内においてヒト生理機能を調べる研究や、非臨床研究、創薬研究などにも利用することができる。
これまではヒト化マウスを中心に研究が行われてきたが、ラットはマウスに比べて体のサイズが約10倍あることから、血液や胆汁、細胞をたくさん採取することが可能だ。
また、生理学、薬理学、神経行動学、移植研究などに広く利用されている実験動物であり、ヒト化ラットは、ヒト化マウスに比べてさまざまなメリットがあると考えられると、研究グループはいう。今後は、今回成功しなかったヒト血液幹細胞を移植したヒト化ラットなどの開発に取り組んでいきたいとしていいる。
さらに研究グループは、今回開発された重症免疫不全SCIDラット、FSGラットは、がん研究、幹細胞研究、移植研究、創薬研究などに幅広く利用されるモデル動物になることが期待されるともコメントした。