筑波大学は、光源に白色レーザーを用いた「コヒーレント・ラマン分光法」による分子の「キラリティ」検出に成功したと発表した。
成果は、筑波大 数理物質系の加納英昭准教授らの研究グループによるもの。研究の詳細な内容は、8月22日付けで米国物理学会発行の学術誌「Physical Review Letters」に掲載された。
物体の形に関して、似た形をしているが、鏡に映した像が実像とは重ならないものを「キラル」、その関係をキラリティという(反対に、実像と鏡像が重なるものは「アキラル」)。具体的な例を挙げると、右手と左手がそれだ。同じ構造を持っているわけだが、鏡像対称の形にあるため、向かい合わせにしないと重ならないというわけだ。
分子でもその立体配置が右型か左型かという、キラリティを持つものが多い。右型と左型では形は似ているのに、生体への作用が大きく異なる場合があり、例えば柑橘系の香料「リモネン」は、右型だとオレンジの香り、左型だとレモンの香りがするという具合だ。
「キラルな分子」は、生命活動を行う上でも重要なカギを握っている。例えば、タンパク質は左型のアミノ酸で、核酸は右型の(デオキシ)リボースで構成されており、偏り=「ホモキラリティ」(キラル分子の2タイプの内の1タイプだけが偏って存在すること)があるのだ。
かつて、睡眠薬のサリドマイドを服用した妊婦から奇形を持つ子供が生まれた事件があったが、これは催眠性を持つ右型のサリドマイドに催奇性のある左型のサリドマイドが混入していたことによる悲劇だった。
このように、分子の立体配置は左型と右型を間違うと生命にとって非常に影響が大きく、その合成で仕分ける技術は重要である。実際に、キラル化合物を効率的に仕分けて合成できる原理を確立したことで、現在は理化学研究所の理事長を務める野依良治博士が2001年にノーベル化学賞を受賞したというわけだ。
現在、分子のキラリティを測定する分光手法としては、主に「円偏光二色性(CD)」、「振動円偏光二色性(VCD)」、「ラマン光学活性(ROA)」などが用いられている。
これらの手法は、キラル分子の絶対立体配置の決定に用いられるのみでなく、多くの不斉点を持つ巨大キラル分子であるタンパク質、DNAといった生体分子の構造の解明にも広く使われているところだ。
これらの測定がフェムト秒からナノ秒の時間分解能で行えるようになれば、数多くの生体内反応の分子メカニズムの解明へとつながるとされている。
近年、CDに関してはパルスレーザーを用いたナノ秒~ピコ秒の時間分解測定が報告されており、可視光~近赤外の領域に吸収を持つ一部の分子に関しては、過渡的なキラリティの観測が可能となってきた。またVCDに関しても、最近はパルスレーザーを用いた測定手法の開発がなされ、時間分解VCD測定への端緒が開かれたところである。
一方、ROAに関しては、その測定の難しさから、パルスレーザーを用いた測定はこれまでのところ報告されていない。ROAは、右回りと左回りの円偏光を入射した際に得られる「ラマンスペクトル」の差を取ることで得られるが、元々のラマン散乱光が微弱であることに加え、それらの差が非常にわずか(ラマン散乱強度の1000分の1程度)であるため、連続発振レーザーに比べて不安定なパルスレーザーを用いた測定は困難であると考えられていたのである。
加納准教授らが今回開発したのは、白色レーザーという新しい高原を用いることで、微弱なラマン散乱光を増幅できるコヒーレント・ラマン分光法を用いた装置だ(画像1)。これにより、パルスレーザーを用いたROA測定に世界で初めて成功したのである。加納准教授らによれば、「最新の教科書をも書き換える画期的な成果」という。
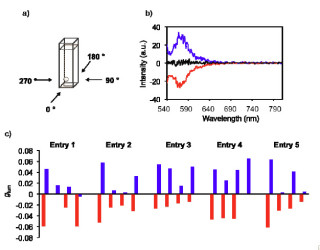
画像1は、今回の実験の概略図だ。直線偏光(縦偏光)のレーザー光(その内の1つは白色レーザー)を試料に照射すると、分子のキラリティに依存して異なるスペクトル形を持つ横偏光の信号光(CARS-ROA光)が発生。右型と左型の分子では、そのスペクトルは正負逆の形状を示す。
画像2がそのスペクトルで、グラフ中の(a)は測定したCARS光のスペクトル(アキラル・バックグラウンド)。(b)は、偏光分解したヘテロダイン測定により得られた、CARS-ROAスペクトルだ。(a)で示したアキラル・バックグラウンドに対して、1/10程度の信号強度が得られている。通常のラマン散乱(自発ラマン散乱)を用いた場合、信号強度は1/1000程度であるため、信号対バックグラウンド比が100倍改善された。(c)は通常のラマン散乱(自発ラマン散乱)を用いて得られた、ROAスペクトル(ほかの研究グループによる報告より)。
通常のラマン散乱法を用いる従来の手法では、微弱なキラリティに由来する信号を、その1000倍程あるアキラル由来のバックグラウンドの中から見出す必要があった。
今回の手法では、入射するレーザー光の偏光および信号光の偏光を精密に制御することにより、アキラルバックグラウンドを抑え、「キラル信号:アキラル・バックグラウンド比」を1:10程度にまで改善することに成功した。
これにより、比較的不安定なパルスレーザーを光源として用いても、キラル由来の信号がバックグラウンドに「埋もれて」しまうこともなく、ROA測定が可能となったのである。
そして実際に、新たに開発した「偏光分解ヘテロダインCARS法」を用いて、キラル分子である「(-)-β-pinene」のROAスペクトルの測定が行われた。得られたCARS-ROAスペクトルはヵ国に報告されている連続発信レーザーを用いたROAスペクトルとよく一致し、開発した手法がROA測定法として有効であることが示されたのである。
今回開発した手法は、原理的にはほぼすべてのキラル分子に適用可能だ。特に、生化学上極めて重要であるにも関わらず、CDやVCDによる測定が困難な水溶液中における透明な生体分子の構造変化の観測において強力な武器になることが期待されている。
それも、X線構造解析のように、生体分子を結晶化せずに研究することが可能なため、生細胞内で機能しているキラル分子のありのままの様子をとらえることができる点は、大きな特徴だ。
研究グループは今後、水溶液中のタンパク質の構造変化の追跡、機能発現の機構の解明、円偏光照射による分子のキラリティの偏りが生じる機構の解明、それによる生体内分子にホモキラリティが生じた起源の解明、生体分子とキラル分子の相互作用の機構解明による製薬への応用といった波及効果が期待されると、加納准教授らはコメントしている。