東京大学は、細胞が使用済みのタンパク質をリサイクルするために利用する酵素「Hdac8」の同定に成功したと発表、同時にフィラデルフィア子供病院と共同で、Hdac8の失活が重度の四肢形成異常、精神発達遅延などを伴う遺伝病「コルネリア デ ランゲ症候群(Cornelia de Lange Syndrome:CdLS)」の原因となっていることも明らかにしたとした。
同成果は、東大 分子細胞生物学研究所 エピゲノム疾患研究センターの白髭教授、坂東助教、中戸助教らの研究グループによるもので、英科学誌「Nature」オンライン版に掲載された。
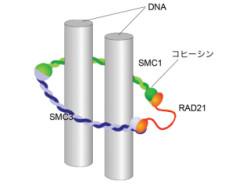
「コヒーシン」は、「SMC3」、「SMC1」、「RAD21」の3つのタンパク質から構成されるリング状の複合体だ。このリングの内側にゲノムを抱え込むことで、ゲノムの分配および遺伝子発現の制御を担う機能を発揮する(画像1)。
タンパク質「NIPBL」の働きによってゲノムに結合し、タンパク質「Esco」によりアセチル化され、ゲノム上でその機能を発揮する仕組みだ。そして、この複合体は役割を果たした後に、ゲノムから除去される際には酵素「セパレース」によりRAD21タンパク質が切断され、取り除かれる(画像2)。
白髭教授らの研究グループは2008年に、コヒーシンが遺伝子の区切り壁の「インシュレーター」として機能し、ヒトの遺伝子発現プログラムを統括的に制御していることを明らかにしていた。また、NIPBLの変異により発症したCdLS患者の細胞中では十分な量のコヒーシンがゲノムに結合できず、結果、遺伝子発現制御プログラムが機能不全に陥り、同症を発症することも解明している。しかし、NIPBL変異により発症するCdLSは全体の6割に過ぎず、残りの症例については原因遺伝子が特定されていなかった。また、ゲノムから除去後のコヒーシンがどのように代謝されるのかについても不明だったのである。
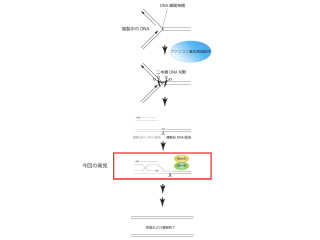
研究グループは、コヒーシンタンパク質が「アセチル化修飾」を受けていることを手がかりに(画像3)、コヒーシンからアセチル基を取り除く活性を持つ酵素の検索を「RNA干渉法」により網羅的に行った。その結果、Hdac8をコヒーシンの脱アセチル化酵素として生化学的に特定した次第だ。
Hdac8の欠損をRNA干渉によりヒト細胞で引き起こし、「ChIP-seq法」を用いて全ゲノムDNA上のコヒーシンの結合箇所を調べた結果、正常な細胞に比べて2割、その結合箇所が減少していることが確認された。
コヒーシンの結合箇所の減少は、CdLSの疾患細胞で共通に見られる傾向であることから、原因遺伝子の特定されていないCdLSの症例についてHdac8遺伝子の配列を調査。すると、8例から変異が見つかり、いずれの患者由来の細胞についても、以下の3点が確認された。
(1)Hdac8の活性が低下していること。(2)詳細に調べた2例については、1塩基の変異によりHdac8タンパク質そのものが著しく少なくなっており、コヒーシンのアセチル化は亢進し、ゲノム上のコヒーシンの結合箇所が2割減少していること。(3)本来細胞中では存在しないはずの使用済みの(切断された)コヒーシンがゲノム上に残留していること。
つまり、Hdac8は本来ゲノムから除去された使用済みコヒーシンタンパク質から、切断されたRAD21断片を取り除き、新たなRAD21と置換することでコヒーシンのリサイクルを促進していた(画像3)のである。
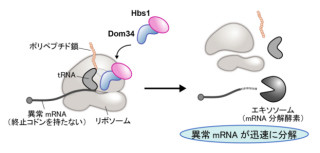
しかし、Hdac8が欠損した患者の細胞中では、使用済みタンパクから、切断されたRAD21を取り除くことができないため、ゲノム上で機能できる正常なコヒーシン量が不足し転写プログラムの異常が生じていたというわけだ(画像4)。Hdac8は、ゲノムから除去されたコヒーシンをリサイクルするために必要だったのである。
今回、ヒトにおけるコヒーシンタンパク質のリサイクル機構を同定し、さらにHdac8を新たなCdLSの原因遺伝子として同定できたことは、脱アセチル化活性を指標に、同疾患の治療薬(特に神経症状)の開発に貢献できることが考えられるという。
また、コヒーシンの変異は近年、悪性腫瘍の発生とも深く関わっていることが報告されており、Hdac8の阻害剤は新たな抗がん剤の候補になりうるかもしれないと、研究グループはコメントしている。