理化学研究所(理研)と住友化学は6月14日、眼組織の原基である胎児型の網膜組織「眼杯」を、ヒトES細胞から試験管内で立体形成させることに成功し、同時に網膜組織の多層構造の立体再構築を実現し、これを冷凍保存する技術も開発したことを発表した。
成果は、理研 発生・再生科学総合研究センター 器官発生研究グループの笹井芳樹グループディレクターと住友化学 生物環境科学研究所(坂田信以所長)を中心とした研究グループと、大阪大学タンパク質研究所の研究者らの協力によるもの。研究は、文部科学省の「再生医療の実現化プロジェクト」の一環として行われた。研究の詳細な内容は、米科学誌「Cell Stem Cell」6月14日号に掲載の予定だ。
ES細胞やiPS細胞などの多能性幹細胞は、すべての種類の体細胞に分化する能力(多能性)を有しており、試験管内で医学的・産業的に有用な細胞を産生する提供源として注目を集めている。
例えば、ある細胞種が生体内で変性するために起こる病気に対し、多能性幹細胞から分化させた細胞を移植して治療する再生医療は、難病克服の切り札として期待が寄せられているというわけだ。
特に脳や網膜などの中枢神経系組織は、再生能力が低く、障害を受けた組織が自然回復することはほとんどない。従って、疾病や外傷などで失われた細胞や組織を、幹細胞から作製して移植する画期的な治療法確立を目指し、国際競争の中で研究開発が進んでいる状況だ。
また、多能性幹細胞から分化して得られたヒト由来の細胞は、ヒトに対する化学物質の影響を精緻に評価できると考えられ、化学物質の安全性評価や創薬への利用に向けた研究開発も進められている。
2005年に理研を中心とした研究グループは、ES細胞などから神経細胞やその前駆細胞を効率よく分化させる方法として、「無血清凝集浮遊培養法(SFEBq法)」を開発。
同方法は、大脳皮質神経細胞、小脳神経細胞などの医学的に有用性の高い細胞の分化に応用されている。また、SFEBq法はこれらの個々の細胞への分化に加えて、大脳皮質などの立体組織を試験管内で形成させることにも応用可能であることを示唆した。
そして2011年には、この技術をさらに改良し、マウスES細胞のSFEBq法により、マウス胎児の眼の原基である「眼杯」の立体組織を試験管内で形成することに成功したのである。
この眼杯形成は、自己組織化で起こり、高度にマウスの眼の発生を再現するものだ。自己組織化で生み出された眼杯組織は、長期培養することで、生後の眼に見られるような複雑な多層構造の形成が可能である。
今回、研究グループは、こうした自己組織化技術の医学応用及び産業応用に向けて、ヒトES細胞からの眼杯及び立体網膜組織の試験管内産生に挑戦した。
ヒトES細胞は、マウスES細胞と共通点があるものの、分化培養条件の詳細については異なる点が多いことも知られている。まず研究グループは、SFEBq法の培養液などを最適化することで、ヒトES細胞から効率よく「網膜前駆組織」を発生させることを可能にした。
その上で、眼杯を構成する「神経網膜組織」と「色素上皮組織」のそれぞれが、同程度分化するように、培養液の組成をさらに最適化したのである。
最適化した培養条件下でSFEBq法を用いたところ、ヒトES細胞から眼杯の立体構造が形成することに成功。まず、培養開始後14~17日に網膜前駆組織は凝集塊の表面から袋状の細胞シート構造として外へ突出した。この風船を膨らませたような構造は、胎児の網膜発生の初期に見られる「眼胞」という構造によく似ている。
培養開始後22日には、眼胞の先端に近い部分が内側に折れ曲がり、眼胞の内部に入る(陥入)ようになった。さらに培養開始後24~26日には、ブランデーグラスのような杯様の立体構造となり、胎児の眼杯にそっくりな形となった(画像1・2)。
画像1は、ヒトES細胞からの立体網膜の自己組織化の模式図。ヒトES細胞のSFEBq法により、まず間脳の前駆組織が形成され、培養開始14日後ごろにその一部が網膜前駆組織に分化する。網膜前駆組織に分化した部分は、ただちに外側に向かって、袋状に突出し始め、培養開始17日後ごろに眼胞を形成。その先端部分は神経網膜に分化すると共に、次第に内側に陥入して、眼杯を形成する。
この眼杯形成は、外部からの力や刺激を必要とせず、組織が自律的に形作る自己組織化に基づく。さらに培養を続けると、画像4にあるように、神経網膜は網膜特有の多層化した構造を呈する。
画像2は、ヒトES細胞由来の眼杯の自己組織化の様子。上段は、ヒトES細胞由来の眼胞の突出の経時的な変化を撮影したもの。下段は、ヒトES細胞の立体培養で自己組織化した眼杯を撮影したもの。緑色は、網膜のマーカー遺伝子であるRxの発現を示す。
また、ヒトES細胞由来の眼胚の大きさは、ヒト胎児の眼胚と同様のサイズ(直径500~600マイクロメートル(μm))で、マウスES細胞由来の眼杯(250~300μm、マウス胎児の眼杯も同様)の約2倍の大きさになった(画像3)。
画像3は、ヒト胎児眼杯と同様の径を有するヒトES細胞由来の眼杯を撮影したもの。初期胎児の眼の発生において、マウスの眼杯とヒトの眼杯では2倍ほどヒトの眼杯の直径の方が大きい(体積では10倍近く大きいことになる)。
同様に、ES細胞培養により試験管内で自己組織化させた眼杯の場合も、ヒト細胞由来のものはマウス細胞由来のものに比べて2倍程度大きく、ヒト胎児眼とほぼ同じ大きさ(直径550~600μm)を持つ。
さらに、形や大きさだけではなく、生体の網膜と同じように、陥入した部分は神経網膜組織に、陥入しない杯の外側の部分は色素上皮組織に分化した。
以上から、ヒトES細胞由来の眼杯は、ヒト胎児の眼杯と極めて似たものとして形成されることがわかる。また、ヒトES細胞由来の眼杯の形成は、外部からの力や構造物からの作用ではなく、自己組織化によって起こることも明らかになった。
続いて、研究グループは、ヒトES細胞由来の神経網膜組織を長期培養することで、成熟した網膜特有の細胞である視細胞や神経節細胞が発生するかを検討。
ヒトES細胞由来の神経網膜組織を立体培養すると、培養開始後(ヒトES細胞の分化開始から)30日の組織には、まず神経節細胞が発生した。また、40日目には少数の視細胞の出現を認め、60~126日までに視細胞は徐々に数を増したのである。
126日後の神経網膜組織は、生体の網膜同様に透明度が高い特徴的な組織だった。さらに、一番外側に視細胞の層が、一番内側には神経節細胞の層が形成され、その間に介在神経細胞の層ができるなど、多層化した構造を示した(画像4)。
画像4は、多層化した神経網膜の自己組織化(ヒトES細胞由来)した様子を撮影したもの。ヒトES細胞の自己組織化培養で産生された神経網膜の組織を単離して、長期立体培養を行うと、5mm大の大きな網膜組織に成長する。
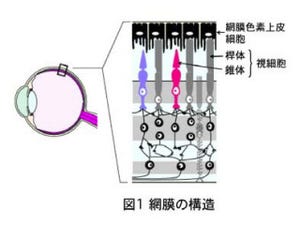
その組織は、網膜特有の多層構造を示し、最も外側には視細胞(錐体細胞、棹体細胞)の層が、一番内側には神経節細胞の層が自発的に形成されるのが確認された。その間には、介在神経細胞や双極細胞の前駆細胞などが存在する。
画像中の「Crx::Venus」及び「Crx」は視細胞のマーカー、「Nrl」は棹体細胞のマーカー、「Tul」は神経節細胞のマーカー、「Chx10」は双極細胞とその前駆細胞のマーカー、「Ptf1a」は介在神経細胞のマーカー。
網膜で光を受ける視細胞には、暗いところでも感度よく物体を見るための「棹体(かんたい)細胞」と、明るいところで解像度よく物体を見たり、色を識別したりできる「錐体(すいたい)細胞」がある。錐体細胞は、ヒトやサルなどでよく発達しているが、夜行性であるネズミなどでは発達が悪く、少数しか存在しない。
作製したヒトES細胞由来の神経網膜組織には、棹体細胞と共に多数の錐体細胞が存在していた(棹体細胞と錐体細胞の数の比は約3:1)。一方、マウスES細胞由来の組織には錐体細胞はほとんど存在しなかった(全体の1%以下)。
このようにヒトES細胞からヒト網膜と同様の性質を有した多層化した構造を自己組織化できることが判明。また、こうして作製した自己組織化網膜は、高純度で網膜細胞以外の細胞を含んでいない。そのため、免疫不全マウスに移植してみても、奇形腫などの腫瘍の形成はまったく認められなかった。
視細胞は網膜難病で変性することが多く、再生医療を考える上で重要な細胞だ。視細胞は、ヒト胎児の発生の中では200日以上かけてゆっくりその発生が進み、数を増してゆく。
同様に、ヒトES細胞の立体培養でも、十分な数の視細胞を産生するには、100日間以上の長期培養が必要だ。しかし、長期培養を維持するには、技術的にもコスト的にも困難が伴う。
そこで研究グループは、視細胞をより早期に効率よく分化させる技術を開発。マウスの発生研究から、視細胞の分化を遅らせる原因の1つとして、細胞表面のタンパク質「Notch」が知られていた。
そこで、このNotchの機能を阻害する薬剤「DAPT」を培養開始後29~43日目まで添加したところ、43日目には、神経網膜組織全体の78%が視細胞に分化したのである。
一方、「DAPT」を添加しない場合は、同じ段階で2~5%程度の細胞が視細胞に分化したに過ぎなかった。このように、約6週間という比較的短期間の培養で、選択的に視細胞を分化させることを可能にしたのである。
なお、研究グループは今回、ヒトES細胞用いて、立体網膜組織を効率よく大量に産生できる技術を確立した。これを網膜難病の再生医療や化学物質の安全性評価・新薬開発などに利用するためには、高い品質の立体網膜組織を適時に供給できることが重要だ。
しかし、ヒトES細胞からの立体網膜の自己組織化には、上記の通り数週間~10数週間の長期培養が必要となり、適時性の面で限界がある。また、そのような長期培養の場合、品質管理は困難で、品質のブレが生じる危険も考えられた。
こうした問題を解決するため、研究グループは、ヒトES細胞由来の多層化網膜組織を長期培養期間の任意の段階で、冷凍保存する技術を開発。既存の凍結液を用いた方法では、液体窒素中で急速に凍結する「急速凍結法(ガラス化法)」でも、-80度のフリーザーでゆっくり凍結する「緩徐凍結法」でも、解凍した後の組織は大きく傷み、網膜発生は起こりにくくなるのが確認された。
そこで、立体網膜組織を独自に工夫した前処理液に氷上で浸し、その後に液体窒素で急速凍結する2段階凍結法を開発(画像5)。これにより、どの段階の立体網膜でも液体窒素中で保存が可能となり、解凍して培養を続けても、90%以上の組織が良好な状態で網膜発生を続けることができたのである。
画像5は、ヒトES細胞由来の立体網膜組織を凍結保存する技術の流れと、凍結→解凍後の神経網膜の様子を撮影したものとその拡大写真だ。従来の急速保存法(ガラス化法)では、立体網膜組織は凍結・融解で傷害ストレスを強く受け、網膜組織の生存は低かった。
今回は、急速凍結の前に、氷上で前処理液に組織を浸すことで、網膜組織の生存を大きく改善することに成功。105日間培養して多層化した神経網膜をこの方法で凍結保存した後、融解してさらに3週間培養(126日相当)したもの(画像5・右下)を見ると、錐体細胞や棹体細胞などの視細胞の層もキレイに形成されることがわかる。
この方法を用いれば、大量に作製したヒトES細胞由来の立体網膜中から高品質のものを選んで凍結保存しておき、必要時に解凍・培養して移植や化学物質の安全性評価・創薬などに用いることが可能となる。これは、実用化を目指す上で非常に有用な技術だ。
また、今回は多能性幹細胞であるヒトES細胞から人為的にヒトの眼杯を産生することに成功したことから、ヒトiPS細胞でも同様の方法で立体網膜組織が産生可能であると考えられる。
従来の幹細胞研究では、細胞レベルの分化制御によって、ドーパミン神経細胞や色素上皮細胞など個々の有用細胞の産生を目指してきた。その成果の一部は「次世代の再生医療」として臨床研究や化学物質の安全性評価・創薬研究につながろうとしている。
これに対し、研究グループは、ヒト多能性幹細胞から多種類の細胞で形成される複合的な組織(眼杯やそこから発生する多層化神経網膜組織など)が、試験管内で自己組織化により形成可能であることを今回示した形だ。
これにより、ヒトの複合組織や器官の再生研究が大きく前進することが期待でき、それらを用いる「次々世代の再生医療」の実現への貢献や化学物質の高度な安全性・薬効評価などへの応用につながると考えられる。
ちなみに、今回の再生医療研究の応用が期待される対象疾患に、「網膜色素変性症」がある。この疾患では、遺伝的な原因などで網膜の視細胞が徐々に変性・減少し、最悪の場合は失明に至る強い視覚障害を引き起こす。
ヒト網膜は、非常に多くの視細胞が細胞密度の高い厚い層を作り、各層の細胞同士が連結して機能している。従って、網膜色素変性症の治療には、こうした複雑な視細胞の層構造を再現する必要があり、生体に近いヒトES細胞由来の立体網膜組織は有用な移植材料となることが期待できるというわけだ(画像6)。
画像6は、ヒト立体網膜組織を用いる次々世代再生医療の例として考えられる網膜色素変性症(左)と健常な網膜の層構造を撮影したもの。網膜色素変性症は、日本で数万人の患者が罹患している比較的に頻度の高い疾患で、失明に至る難病である。視細胞、特に棹体細胞が変性してしまうことが原因だ。
これを、ヒト多能性幹細胞から自己組織化させた立体網膜組織を移植して、視細胞を補充するような治療する再生医療が期待できる。
さらに、今回開発された立体網膜組織内の視細胞分化を大きく促進するNotch阻害剤法や、5mm大の網膜組織の形成を可能にした長期立体培養技術は、網膜色素変性症への移植治療の実現を後押しするものと期待できる。
現在理研では、研究グループと網膜再生医療研究開発プロジェクトの高橋政代リーダーらとの共同研究により、動物眼への移植研究を進めており、ヒトES細胞由来の立体網膜組織の医療応用に向けた、技術開発も進行中だ。
また、今回開発された凍結保存技術も、実用化に大きく貢献すると期待できるという。同技術により、作製した立体網膜組織を、必要な時に必要な分だけ得ることが可能となる。また、遠隔地の研究機関や病院にも高品質のヒト立体網膜組織を届けられることだろう。将来、複数の研究機関が連携して臨床試験などが実現する可能性が高まるというわけだ。
さらに凍結保存技術は、移植組織の品質管理を容易にし、安全性を高めることも可能である。立体網膜組織を多数作製し、高品質のものを選別して凍結保存しておき、その一部をウイルス感染テストや動物移植による腫瘍形成テストなどの品質チェック(抜き取り試験)に用いることで、安全性が担保された移植組織の提供が可能となるというわけだ。さらに、高品質のヒト立体網膜組織を化学物質の安全性評価試験などに供する場合は、試験結果の再現性の向上が期待できる。
ヒトの生体組織に近い立体網膜組織が簡便に作製可能となったことで、今後、ヒトの網膜に作用する新薬の開発や遺伝子治療法の開発、あるいは網膜難病の発症メカニズムの解明などにも寄与できると期待できると、研究グループはコメント。
また、疾患特異的iPS細胞の技術と組み合わせて、「疾患モデル網膜組織」を作り出し、これまでにない研究開発材料を提供することも将来的に可能となるとしている。