東京女子医科大学と科学技術振興機構(JST)は5月16日、従来の学説を覆す発見として、末梢感覚神経を切断すると、脳内の「ニューロン」(神経細胞)同士の配線(神経回路)が従来考えられてきた時期よりはるかに早い時期に大きく「つなぎ換え」られることを明らかにし、同時につなぎ換えられた神経回路の物質的変化と機能も明らかにしたと発表した。
成果は、東京女子医科大医学部の宮田麻理子教授らの研究グループによるもの。研究の詳細な内容は、米国東部時間5月16日付けで米神経科学学会誌「The Journal of Neuroscience」に掲載された。
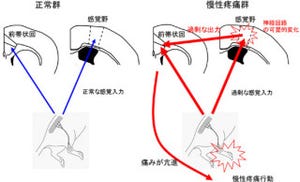
脳には身体部位に応じて身体感覚を知覚する機能局在「脳地図(身体部位に応じて身体感覚を感じる脳の機能局在地図)が存在する(画像1)。脳地図は、ニューロン同士の配線である神経回路によって形成される仕組みだ。手足を切断するなどして、末梢の感覚神経が切断されると、脳地図が再構築されることが知られている。
例えば、腕を切断した患者さんの脳を機能的MRI画像計測(fMRI)で計測すると、失った腕に対応する脳領域が縮小し、腕の隣に位置する顔面領域が拡大してくるのだ。サルやネズミの実験でも同様の変化がこれまで観察されている(画像1)。
このような変化は、脳自体が持つ補償能力だが、外界環境との不適合も引き起こすことが知られていた。手足を切断した後に失ったはずの手足があたかも存在するかのように感じ、激しく痛むという「幻肢痛」という難治性の痛みがそれであり、手足の切断患者(年間5000人)の50~80%が幻肢痛を体験するほどだ。
幻肢痛発症には、脳地図変化が中心的な役割を果たしていると考えられているが、その変化のメカニズムは多くの謎に包まれている。そもそも成体の脳では神経回路は安定しており、簡単にはつなぎ換えられないと長年考えられてきた。
神経損傷研究における霊長類やアライグマを用いた研究では、損傷後何年も経って初めて大規模な神経回路の配線の変化が認められている。このため、損傷直後は新たに配線ができるのではなく、まず脳の中に潜在していた配線が顕在化して回路におけるニューロンの機能が可逆的に変わるとしてきた。
その後、何年という長期間を経て新たに配線ができて、回路のつなぎ換えが不可逆的に生じるという仮説(画像2)が受け入れられてきたのである。そして、幻肢痛の発症には、潜在していた配線の顕在化の仕方が影響していると考えられてきたというわけだ。
一方、神経回路やニューロンより小さな、スパインと呼ばれるニューロンの情報を受け取る微細部位では、最近の解析技術の進歩により、神経損傷後数日以内に形が変化することがわかってきた。従って、従来の仮説に基づく神経回路レベルの変化ではスパインレベルの変化とは時間的に大きなズレがあったのである。
このような時間的ズレの背景には、技術的な理由から今まで末梢神経損傷後の脳の中の神経回路の変化を詳細に時間を追って調べた研究がなかったことが原因に挙げられるという。
脳地図は、視床と、視床から投射を受ける大脳皮質の感覚野に存在するが、視床はそもそも観察のための標本作成が技術的に難しく、また大脳皮質は神経回路がとても複雑で、いままでの研究ではその変化がどの神経細胞から入力している神経回路なのか同定することはできなかった。
また、末梢神経切断後、神経回路においてニューロン同士の情報伝達の仕方がどのように変化するのかも不明だったのである。
幻肢痛に対しては、現在のところ有効な薬物療法はない。近年、脳地図を再び正常地図に戻すような触覚の訓練をすることによって、鎮痛効果を図るリハビリが行われているが、このようなリハビリ法の多くは臨床の現場での経験則で開発されたものが多く、最適で効率化されているとはいい難い状況だ。
しかも、いつリハビリを開始し、どのようにリハビリ効果を測定評価していくかは十分に確立していないことから、幻肢痛のリハビリを行う施設は、国内では極めて少ない状況となっている。効果的な治療法の開発のためにも、脳地図変化の詳しいメカニズムを明らかにすることが急がれていたというわけだ。
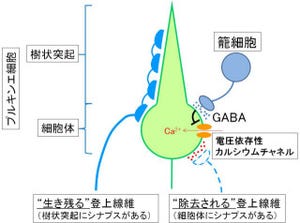
マウスのヒゲは、探索行動をするための、ヒトでいうならば手のような役割を果たしている。マウスのヒゲの感覚はまず「三叉神経核」というニューロンの集団に伝達。
三叉神経核のニューロンからは、軸索という長い突起が出て内側毛帯線維という束になって、視床と呼ばれる中継場所のニューロンに「シナプス」(ニューロンとニューロンの接合部)を作る。
そこで感覚情報が一旦伝達されて、最終的に大脳皮質に送られる形だ。視床や大脳皮質にはヒゲや顔、手足に対応した脳地図が存在することがわかっている(画像3)。
そこで宮田教授らは、マウスのヒゲの感覚神経を完全切断して、ヒゲの入力を失った視床のニューロンでの神経回路の変化を詳細に解析した。宮田教授らが独自に確立した視床スライス標本を用いて、「スライスパッチクランプ法」で神経活動を記録することにより、視床のニューロンに入力している内側毛帯線維のみを選別して、その入力本数と感覚情報の受け渡し方(情報伝達様式)を詳細に解析したのである。
なおスライスパッチクランプ法とは、生きた脳切片内のニューロンにガラス電極を当てて生理現象を記録する方法のことだ。シナプスやニューロン自身の微小な電気活動を非常に感度良く観察することができるのが特徴である。
実験の結果から、通常の視床のニューロンは1本の内側毛帯線維から入力を受けるが、切断した動物では、予想よりはるかに早く切断後6日目には新たな複数本の線維から入力を受けるようになり、視床の神経回路の配線が早期から大きくつなぎ換えられることが判明した(画像4・5・8)。

|

|
|
画像4(左)・5。末梢神経損傷後の内側毛帯線維投射変化。 全細胞パッチクランプ法により、視床神経細胞から内側毛帯線維を介するシナプス電流が記録された。神経損傷後には階段状のシナプス電流増加が記録され、複数の内側毛帯線維投射が示唆されたのである |
|
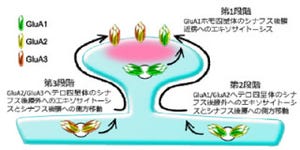
損傷前に存在していた神経配線は損傷後1週間以内に弱くなり、それを補うように新たな内側毛帯線維が視床のニューロンにシナプスを形成することも確認。さらに新しくできたシナプスには、発達期でのみ観察される神経伝達物質「グルタミン酸」の受容体「GluA2」が発現しており、「若い」性質を持つこともわかった(画像6~8)。感覚情報の伝え方も、成体に比べて時間的に遅い性質を持つことが判明。

|

|
|
画像6(左)・7。末梢神経損傷後のGluA2受容体発現増加。影響側(contra)の視床(VPM)においては、内側毛帯線維終末の指標分子である「VGluT2」と共存するGluA2の免疫組織化学反応が増加している |
|

|
|
画像8。末梢神経損傷による視床神経回路つなぎ換え現象の模式図。末梢神経損傷後わずか1週間以内に視床では内側毛帯線維が1本支配から多重支配に変化。加えて、新しく作られた神経回路では若い時期にしか存在しないGluA2にいう受容体が出現してくる |
今回の研究の結果は、損傷後の脳地図の変化の初期過程を神経回路の機能レベルでとらえた世界で初めての発見だ。近年、損傷早期にスパインなどのニューロンの微細構造レベルで変化することが報告されていたが、神経回路のレベルにおいても大規模な配線換えが、今までの学説を覆しはるかに早い時期に起きていることが今回の研究で初めて明らかになった。
これまでの仮説では、幻肢痛に関して神経回路自体が換わるのには数年かかると考えられてきたが、今回の結果から、損傷後わずか1週間以内にまもなく新しい配線ができ出し、つなぎ換えが始まることが明らかになった形だ。
成体の脳内でこのような早さで神経回路が変化するという発見は、これまでの学説を覆すものである。この変化がいつまで続くのか現時点では明らかではないが、神経回路の変化が終わって安定してしまった後に、治療によって再度正常な状態に戻すことはやはり難しいと考えられる。
現在、国内では幻肢痛のリハビリ治療は積極的に行われてはおらず、治療実施施設はごくわずかしかない。治療自体も、幻肢痛が発症し、患者の訴えが強くなってから行われていた。しかし、この結果を踏まえると、できるだけ早期、幻肢痛の発症以前から、発症そのものの抑制を目的とした治療を開始することが望ましいと考えられるという。
また、リハビリの効果を計ることができるバイオマーカー(指標)が存在すると、リハビリをその結果を見ながら進めることができ、いま現在幻肢痛に苦しんでいる患者に対するリハビリ効果を高める工夫を行いやすくなる。
今回はGluA2という(神経伝達物質)受容体の1種が、つなぎ換えられた神経回路にのみ観察されることから、GluA2自身がバイオマーカーとなる可能性を持つ。また、GluA2と並行関係を持って増減する血中や脳脊髄液中の成分を検出できれば、それらもバイオマーカーとして利用できる可能性がある。
一方で、成体脳で直接損傷を受けていないニューロン同士の配線が大きく組み換えられるという今回の結果は、大人の脳のニューロンであってもある条件下では柔軟な組み換えられる能力を持つことを意味しているといえよう。
今後さらに詳しい神経回路の組み換えのメカニズムがわかれば、アルツハイマー病などの脳の変性疾患や脳梗塞後の神経再生の治療法にも応用できるかも知れないと、宮田教授らはコメントしている。