|
|
早稲田大学 理工学術院の柴田重信教授 |
早稲田大学(早大) 理工学術院の柴田重信教授の研究グループは、1個体のマウスの体内時計を生きた状態のまま測定する手法を開発したことを発表した。同成果の詳細は、米科学誌「Current Biology」に掲載される予定で、先行して5月10日に同誌オンライン版に掲載された。
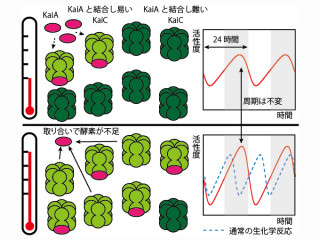
地球上の生物は太陽の自転に合わせて24時間の生活リズムを刻んでおり、そのメカニズムとして約24時間の周期で振動する複数の時計遺伝子の存在が近年明らかにされてきた。
時計遺伝子(Per2, Bmal1)は体の中のあらゆる細胞で発現しており、様々な生理現象に「昼」や「夜」という情報を伝える重要なシステムを担っている。哺乳類の体内時計は、脳にある視交叉上核と呼ばれる神経核が主時計として体の臓器や組織の末梢時計を調節していると考えられてきたが、近年の研究では、生体から切り離し、シャーレなどの上で人工的に培養した組織や細胞でも、同時に時計を調節する能力があることがわかってきた。しかし、この場合、生体内の状況と一致しているとは必ずしも言い切れず(例えば、臓器の一部をスライスして調べたとしても、それは=臓器のすべてとならない可能性もあるし、ほかの臓器や神経、細胞などとのリンクまで再現されるわけではない)、実際の生体内部の細胞や臓器の時計の時間合わせ能力がどの程度機能しているのかは不透明であった。
生きた状態の生体内(in vivo)における体内時計を研究することは、こうした不透明さを払しょくできるようになるほか、実環境上で状態を調査できるということで、より深い研究を実現していくための要素となるほか、臓器間の時計の相互関係を調べるためには必須となることもあり、in vivoでの体内時計測定法の実現が求められていた。
今回、研究グループは、時計遺伝子の下流にホタルルシフェラーゼ遺伝子を導入したマウス(PER2::LUC マウス)と高感度EMCCDカメラを搭載したCaliper製in vivo imaging装置「IVIS Kinetic」を用いることで、世界で初めて1個体のマウスの体内時計を生きた状態で測定する手法を開発した。
具体的な手法は、時計遺伝子Per2の下流にホタルの発光酵素であるルシフェラーゼ(Luciferase)をマウスに定められた時間ごとに注射する。このマウスは、PER2::LUCEFERASEという複合タンパク質を生成し、発光基質であるルシフェリンが投与される事で、PER2::LUCIFERASEの量に相関した生物発光が各臓器で見られるようになる。この発光は極微量ではあるが、暗闇の中で高感度EMCCDカメラにて撮影する事で、皮膚から透過した光として臓器の発光を測定する事が出来る。
今回の研究成果の主なポイントは3つあるが、そのうちの1つがこのカメラによる発光の撮影。微細な発光をとらえられるがゆえに、マウスが発光していたとしても、それが温度などの周辺環境の変化によって引き起こされたものである可能性もあり、こうした影響をすべて調査し、影響を受けない状態で生体内の時計を見ることが可能であることが示された。
実際の測定では、発光状態の撮影を4時間おきに24時間連続で行う事で、 発光リズムを得る事に成功した。また、もう1つの時計遺伝子であるBmal1はリズムのピーク時刻がPer2と逆の時間であり、同様の手法をBmal1に発光システムを導入したマウス(Bmal1-ELucマウス)にも適用することで、発光リズムが逆位相になる事も確認されたという。

|
|
in vivo imaging装置「IVIS Kinetic」を用いた際の各臓器の発光状態。今回は特定臓器を発光させるわけではないので、肺や心臓、胃なども光っているはずだが、肝臓や腎臓、顎下腺の光量が大きく、ほかを隠したり、肺などは骨が光を遮る関係から、見られなかったのであえろうとことである(画像提供:早稲田大学 柴田重信教授) |
また、今回の研究により、これまで生体外に取り出した状況での測定であっても、かなりの比率で生体内同様に同期していると考えられてきたが、実際は取り出した際の刺激により、一度リズムがリセットされてしまい、あらためてリズムを形成していることが判明した。さらに2つ目のポイントとして、中枢である視交叉上核を熱破壊したマウスを用いて実験を実施したところ、行動、睡眠・覚醒リズムがほぼ消失。このマウスの末梢組織の肝臓/腎臓/顎下腺の体内時計を測定したところ、振幅が有意に減弱している事を確認し、マウスの末梢組織の体内時計が視交叉上核によって制御されている事が確認された。
そして3つ目のポイントは、視交叉上核が破壊されたマウスではリズムがなくなったものの、外部からの刺激次第ではリズムが再び形成され、各臓器の時計のリズム周期は約23.7時間(具体的には、腎臓が23.71時間、肝臓が23.68時間、顎下線が23.70時間)であり、視交叉上核も同様であることから、主時計(視交叉上核)も末梢時計(臓器や細胞)も似た分子機構で時計を刻んでいる可能性が示された。

|
|
時計遺伝子PER2の腎臓/肝臓/額下線(左/中央/右)の発光リズム。ZTは時刻を表し、この場合は左からZT11(19:00)、ZE15(23:00)、ZT19(3:00)、ZT23(7:00)、ZT3(11:00)、ZT7(15:00)をそれぞれ表す(画像提供:早稲田大学 柴田重信教授) |
実際の実験手法としては、常に餌がある状況と、24時間中12時間しか餌が与えられない状況を用意(実際にはほかの時間周期、例えば22時間周期などでも行ったがリズム形成がみられなかったという)。常に餌があるとリズムがないままであったが、後者ではリズムが生じていることが確認され、それを調べた結果が前述の23.7時間となったということである。確かに主時計と末梢時計の時間が異なれば生体内のバランスに異常が生じるので、そういうことはないはずとの予測はできてはいたものの、これまでそれを実証する手段がなく、今回の実験によりそれが実証されたこととなった。
なお、研究グループでは、今回は視交叉上核を破壊したマウスでの実験であり、例えば時差ボケは目に入る光の刺激が脳に送られる際に体内時計とずれて生じると言われており、その際に、消化器系の体内時計がどうなっているのか、臓器間でもずれが生じているのか、肝臓単体だとしても、健全な肝臓と脂肪肝では異なるのかといったようなさまざまな調査課題が出てくることから、今後はこうした詳細な調査を行っていくとするほか、末梢時計は代謝や免疫、がんの発症などの機能などに関わっているという研究結果もでていることもあり、睡眠障害などのリズム障害者の代謝状況の調査に向けたリズム障害モデルマウスによる疾病や薬物治療による末梢時計の役割解明に向けた研究や、腎臓と膀胱の連動関係の調査などによる腎不全や糖尿病により腎臓への負荷増大の様子と、その治療に向けた研究などを進めていきたいとしている。