科学技術振興機構(JST)、京都大学(京大)、東京大学(先端科学技術研究センター)、千葉大学の共同研究グループは1月30日、抗体を用いることで、重要な医薬品標的分子ファミリーである「Gタンパク質共役型受容体(GPCR)」の結晶化を促進する方法、つまり立体構造を認識する「モノクローナル抗体」(単一の抗体を産生する細胞が作る抗体のクローンで、1種類の抗原とだけ反応する)の作製法を開発し、GPCRと抗体の複合体の立体構造をX線結晶構造解析によって解明したと共同で発表した。また、この複合体の構造を原子レベルで明らかにすることで、新たなGPCRの阻害機構を明らかすることにも成功している。
京都大学医学研究科岩田想教授らの研究グループによるもので、成果は英科学雑誌「Nature」のオンライン速報版で英国時間2012年1月29日に公開された。
近年、新規医薬品開発においては、薬剤の標的となるタンパク質の立体構造に基づいた合理的な薬剤設計が有効であることが示されている。しかし、細胞膜に埋まった構造を持つGPCRでは、結晶化における糊代となる親水性表面が少ないため、質の良い結晶作製が困難であり、ヒトのGPCRの立体構造もこれまでに数個しか解析されていない。
研究グループは、GPCRを効率よく結晶化するために、標的分子と特異的に結合する抗体を結晶化における糊代とすることに着目し、まず抗体の高効率作製法を開発した。その結果、パーキンソン病の薬剤標的である「アデノシンA2a受容体」に対する抗体を多数取得し、この抗体を用いることでアデノシンA2a受容体と抗体の複合体の結晶化に成功し、その立体構造をX線結晶構造解析により決定した。
アデノシンA2a受容体は、「アデニル酸シクラーゼ」促進性のGタンパク質(Gs)と共役するGPCRで、線条体や大脳皮質、海馬、冠血管、肺、血小板など生体内の幅広い部位に分布している。その生理機能は、神経活動の制御、血管拡張、内蔵平滑筋の弛緩など多岐にわたるのが特徴だ。
ちなみにコーヒーに含まれるカフェインはアデノシンA2a受容体の拮抗剤であり、アデノシンの結合を阻害することにより睡眠覚醒作用を示す。コーヒー愛飲者はパーキンソン病にかかりにくいといわれていたが、近年アデノシンA2a受容体の拮抗剤がパーキンソン病などの神経変性疾患に対する効果が正式に認められ、その特異的医薬品創成が盛んに行われている状況だ。
この複合体の立体構造解析からは、抗体分子がアデノシンA2a受容体の細胞内側表面の「くぼみ」に深く突き刺さることにより、受容体の活性化に伴う構造変化を抑制し、機能を完全に阻害していることが判明。この「くぼみ」はGPCRの活性を制御することができる新規の薬剤結合部位であり、まったく新しい阻害機構を持った薬剤の設計が可能になると期待されている。
GPCRは、ホルモンや神経伝達物質などのセンサとして細胞外からのシグナルを受容し細胞内へ情報を伝達する、7回も細胞膜を貫通する構造(7回膜貫通構造)を持ったタンパク質だ。現在使われている薬の約50%が、このGPCRをターゲットとしている。
副作用が少なく、効果の高い薬剤の設計・改良には、医薬標的となるタンパク質の立体構造情報に基づいた薬剤設計(Structure-Based Drug Design)が有効だ。しかし現在のところ、800種類ほどあるGPCRの内、10種類程度の立体構造しか明らかになっていない。これは、GPCRが構造的に揺らぎを持った不安定な分子であるのに加え、結晶化に必須な親水性表面が著しく少ないことが原因と考えられている。
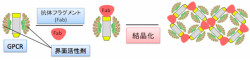
GPCRの立体構造を体系的かつ網羅的に決定していくためには、GPCRと特異的に結合する抗体を用いて、GPCRと抗体の複合体を形成させて親水性表面を拡張し、かつ構造的揺らぎを抑えることによって結晶性を向上させるという戦略が有効だ(画像1)。
|
|
画像1。抗体フラグメントによるGPCR結晶化の促進法。精製したGPCRは親水性領域が小さいため界面活性剤に覆われてしまい、結晶の格子が形成されにくい。GPCRの立体構造を認識する抗体フラグメントを用いて、親水性領域を拡張させて結晶性を向上させるという手法だ |
今回、研究グループは比較的安定なアデノシンA2a受容体をモデルに、結晶性を向上させるモノクローナル抗体作製法を開発し、アデノシンA2a受容体と抗体による複合体の立体構造の解明に挑んだのである。
ヒト由来のアデノシンA2a受容体の生産は、メタノール資化性酵母「ピキア・パストリス(Pichia pastoris)」を用いて行われた。同酵母は高密度培養が可能であるため、組み換えタンパク質の発現系としてよく使われている特徴を持つ。
そして同酵母にアデノシンA2a受容体をより多く作成させるために、いくつかの遺伝子操作を行った結果、アデノシンA2a受容体の端を一部削除し、糖鎖修飾部位に変異を加えたものが最も発現量が高く、結晶化するために十分な量の試料を精製することができた形だ。
次に、立体構造を認識する抗体を得るために、精製したタンパク質をリポソームへ再構成し、立体構造を保持した状態でマウス体内において免疫反応を起こした。この反応により、変性したタンパク質には結合しない24種類のモノクローナル抗体を抽出。これらの内、8種類が「アゴニスト」(作動薬)の結合活性を阻害する機能を持った抗体で、さらにその内の1種類は「アンタゴニスト」(拮抗薬)の結合は何も阻害しないのに、アゴニストの結合を完全に阻害しているのが確認された。
なおアゴニストとは、受容体に結合し、神経伝達物質やホルモンなどの生体内物質(リガンド)と同様の機能を示す物質のこと。そしてアンタゴニストとは、受容体には結合するが、受容体の作用自体は起こさない物質で、本来結合すべき生体内物質が受容体に結合することを阻害する物質のことである。
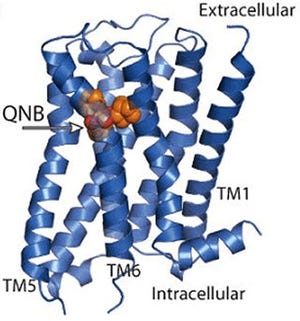
この抗体の「Fabフラグメント」と、精製したアデノシンA2a受容体の1:1複合体を調製した結果、アンタゴニスト「ZM241385」の存在下で良質の複合体の結晶を得ることに成功したのである。英国にある放射光施設「ダイアモンド」のマイクロフォーカスビームを用いて結晶の回折データを収集し、立体構造を決定した(画像2)。
ちなみにFabフラグメント(画像3)とは、抗原との結合領域を含む抗体の一部のことである。抗体はパパイヤに含まれるタンパク分解酵素「パパイン」によって、2分子のFabフラグメントと1分子の「Fcフラグメント」に分解される。抗体フラグメント(Fab)は重鎖(Fab(H))と軽鎖(Fab(L))から形成されている形だ。

|
|
画像3。Fabフラグメント |
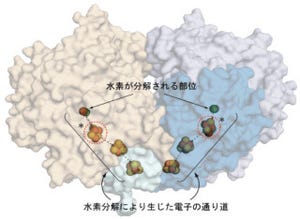
Fab抗体はアデノシンA2a受容体の細胞内側の表面を幅広く認識し、結合していることが確認された(画像2)。特に、抗体の「超可変領域」(Fabフラグメント(画像3)の先端半分にある抗原の結合領域(可変領域)の内、直接抗原と接触するため変化が大きい領域で、「CDR」(complementarity-determining region)と呼ぶ)の1つ「H3」は長く伸びたヘアピン構造を形成し、アデノシンA2a受容体の細胞膜を貫通しているらせん構造の部位から形成される「くぼみ」に深く突き刺さり、水素結合や疎水結合により強く相互作用していたのである(画像4)。

|
|
画像4。抗体の結合サイト(Fab抗体の結合面の表面表示)。抗体の超可変領域(CDR-H1(黄色)、H2(オレンジ色)、H3(赤色)、L1(緑色)、L2(紫色)がアデノシンA2a受容体に結合している表面を示している |
GPCRは活性化に伴い、らせん構造の一部が大きく動くことがすでに判明している。従って、今回のアデノシンA2a受容体と抗体の複合体では、抗体の超可変領域「H3」がらせん構造の相対配置を固定するように結合しているために、アデノシンA2a受容体は活性型構造に変化することができず、これにより作動薬が結合できなくなっていると考えられる(画像5)。
もう少し詳細に説明すると、GPCRは主に細胞膜を貫通しているらせん構造「ヘリックス6(H6)」が構造変化することで活性型構造と不活性型構造の平衡状態として存在していると一般的に考えられている。アゴニストは細胞外から活性型構造に結合し、細胞内のGタンパク質結合を促進することにより、シグナル伝達が発生。同抗体は不活性型構造の細胞内の「くぼみ」に強く結合し、H6の構造変化を止めてしまうことで不活性型に固定し、作動薬およびGタンパク質の結合を完全に阻害するというわけだ。
以上の結果から、同抗体は「アロステリック逆作動薬活性を持つ機能性抗体」であることが明らかとなった。つまり、「生体内物質(リガンド)」が結合する部位とは異なる部位に結合し、完全にタンパク質を不活性化する機能を持った抗体である。また、X線結晶構造解析による立体構造を得ることが難しいGPCRに対して、今回の研究で開発した抗体作製技術が有効であることを示すこともできた形だ。
さらに、GPCRの細胞内側の「くぼみ」に結合してらせん構造の一部H6の動きを固定すれば、GPCRの機能を完全に不活性化できることも明らかにとなった。これらのことから、この「くぼみ」はまったく新しい阻害機構を持った薬剤結合部位になると考えられるというわけである。
なお研究グループでは、今回の研究で得られた超可変領域の構造をもとに、低分子化合物のデザインを行うことで、パーキンソン病の新規治療薬の開発が可能になると期待されるとした。また、アデノシン受容体以外のGPCRに関しても、同様の「くぼみ」が新しい薬剤結合部位になる可能性が示唆されるともコメントしている。今後、今回の研究で開発した結晶化促進抗体作製技術により、結晶構造を得ることが難しかった多くの膜タンパク質の結晶構造が解明されることも期待されるとした。